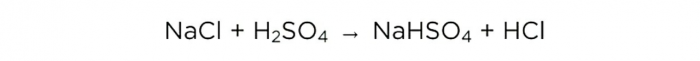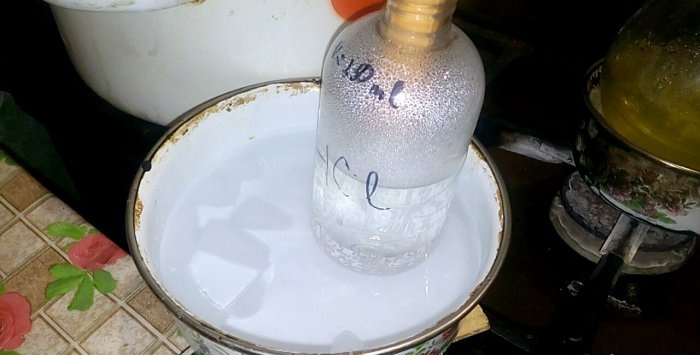Приготвяне на солна киселина у дома
Алхимиците, които за първи път произвеждат солна киселина през 15-ти век, я наричат „spiritus salis“, „дух от сол“. По това време тази киселина имаше магически свойства: разяждаше хартията, разтваряше метали и тровеше хората. Тези свойства остават с него и до днес, но сега тази киселина е достатъчно проучена и тук няма магия.
Солната киселина (HCl) е силна едноосновна киселина, в чиста форма е прозрачна течност. При максимална концентрация от 38% „пуши” във въздуха. Ще получим киселина с концентрация наполовина.
Така че да започваме.
Мерки за безопасност
Внимавайте при работа с токсични вещества!
Всички експерименти трябва да се извършват в добре проветриво помещение или под качулка.Не забравяйте да носите предпазни очила (може да се закупят от железария) и ръкавици (ако не можете да намерите специални химически ръкавици, подходящи са качествени). за миене на съдове).
На мястото на експеримента трябва да има сода за хляб, за да се неутрализира киселината в непредвидена ситуация (това ще освободи въглероден диоксид и вода).
Строго е забранено провеждането на експерименти в метални съдове.
Ще се нуждая
За провеждане на експеримента ще ни трябва:
- Киселинен електролит за батерии (продава се в магазин за автомобили);
- Дестилирана вода (пак там);
- Трапезна сол (предлага се във всяка кухня);
- Сода за хляб (вижте мерките за безопасност).
От съдовете, от които се нуждаете:
- Стъклена колба;
- Съд с пясък, където можете да поставите колбата;
- Няколко еднократни чаши 200 мл;
Ако имате термоустойчива колба, можете да я загреете под открит пламък на горелка. Но все пак препоръчвам да използвате пясък, в този случай той ще абсорбира киселина.
Ще ви трябват и чифт водопроводни ъгли с диаметър 50 mm и горелка (в моя случай алкохол, но препоръчвам да използвате газова).
Етап 1 - изпаряване
Електролитът за батериите е 36% сярна киселина (H2SO4). Първо трябва да увеличим концентрацията му.
Изсипете 200 ml в чашата, тоест почти до ръба, и изсипете малко повече от половината чаша в колбата. Направете маркировка с маркер и добавете останалото.
Поставих рефлектор от фолио около колбата за по-ефективно нагряване, но по-късно го махнах, защото започна да се топи.
Сега поставете колбата върху горелката и изпарете до нивото на предварително зададената маркировка, дори малко по-ниско.
В същото време поставяме няколко пъти сгъната марля на ъгъла и я закрепваме с еластична лента. Пригответе ненаситен разтвор на сода и потопете края на ъгъла с марля в него.
Когато електролитът започне да кипи, поставяме ъгъл върху колбата, тя седи плътно върху нея. Насочваме края на марлята в отворения прозорец.
Това е необходимо, ако внезапно самата сярна киселина започне да се изпарява заедно с водата. Ако не прегреете колбата твърде много, това няма да се случи.
Горелка в действие:
Моята горелка е сравнително ниска мощност, така че изпарението отне около час.Газова горелка или електрическа печка биха ускорили значително този процес.
След завършване на първия етап в колбата трябва да остане малко по-малко от половината от разтвора, т.е. киселина с концентрация около 75%. Не забравяйте за точността.
Оставете да се охлади до стайна температура.
Етап 2 - изчисления
Сега, след като имаме концентрирана сярна киселина, можем да проведем основната реакция, тя изглежда така:
Но първо, нека направим някои изчисления и накрая ще ги сравним с това, което се е случило на практика.
И така, първоначално имахме 200 ml електролит с плътност 1,27 g/cm³. Разглеждайки таблицата с плътностите на сярната киселина, виждаме, че тази плътност съответства на концентрация от 36%. Нека изчислим обема на киселината:
200ml*36%=72ml - V(H2SO4)
След като изпарихме разтвора, неговата концентрация и следователно плътността му се увеличиха. Поглеждаме същата таблица и виждаме, че концентрация от 75% съответства на плътност от 1,67 g/cm³.
Познавайки плътността на тока (p) и обема (V) на киселината, намираме масата:
m=p*V;
m(H2SO4)=1.67g/cm³ * 72ml=120g;
m(H2SO4)=1.67g/cm³ * 72ml=120g;
Сега си спомняме от училищната химия:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
където М е моларната маса на веществото.
където М е моларната маса на веществото.
Моларните маси на H2SO4, NaCl и HCl са съответно 98, 58,5 и 36,5 g/mol. Сега можем да разберем колко готварска сол е необходима и колко HCl ще получим.
А именно, имаме нужда от 72 g NaCl, това е 34 ml, нека го вземем в повече - една четвърт чаша.
Страхотно и HCl на теория ще излезе 44,7 g.
Таблицата за плътност на HCl има колона g/l. Взимаме от там стойността за концентрация 15% - 166,4 g/l. Обемът вода, необходим за получаване на 15% HCl, е 44,7/166,4≈270 ml. Ще вземем 200 мл. В резултат на теория ще получа 22% солна киселина.
Етап 3 - получаване на киселина
Свързваме двата ъгъла, както следва:
И цялата структура ще изглежда така:
Съответната киселина ще кондензира в съд с надпис HCl; обемът на водата в него е 200 ml. Също така маркирайте текущото ниво на течността върху този контейнер.
Отстраняваме ъглите и изсипваме изчисленото количество сол в колбата през фуния.
Разтворът става жълт.
За да започне да се отделя солна киселина, трябва да включите горелката. Но първо прикрепяме плътно ъглите към колбата и приемния съд.
Когато киселината кондензира във вода, се образуват "вертикални вълни". Освен това разтворът се нагрява и трябва да се охлади. Например, можете да поставите друг съд с лед отдолу.
Реакцията протича сравнително бързо - 20 минути, след което можете да изключите топлината. Оставете последните изпарения на солната киселина да се разтворят във водата и след това затворете херметически съда. Когато колбата се охлади, разредете останалия разтвор с вода (приблизително едно към едно) и го излейте в канализацията.
Долен ред
По маркировката на съда определяме колко течност е добавена. За мен е ⅙, тоест 17%. Това е концентрацията на нашата солна киселина. Нека го сравним с полученото на теория.
17%/22%*100%=77% - реакционен добив.
Важно е да се отбележи, че няма изход, равен на 1, винаги има загуби. В моя случай това е недостатъчно изпарен електролит. В идеалния случай концентрацията на сярна киселина трябва да бъде 90-95%.
Нека проверим получената киселина за взаимодействие с метал.
Наблюдаваме бързо отделяне на водород. Това означава, че киселината е подходяща за по-нататъшни експерименти.
Вариации
Можете да използвате чиста стъклена бутилка от бира или сода като колба, но при условие, че нагряването е възможно най-плавно. Вместо PVC ъгли можете да вземете полипропиленови тръби и ъгли с по-малък диаметър (подходящи за вашата колба).
Още веднъж ви призовавам да спазвате мерките за безопасност. Приятни преживявания на всички!
Подобни майсторски класове
Особено интересно
Коментари (19)