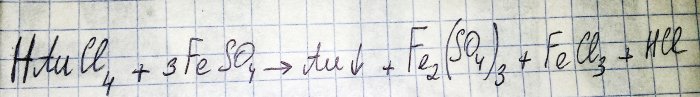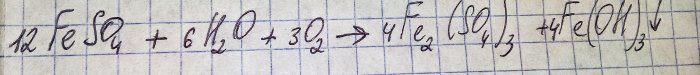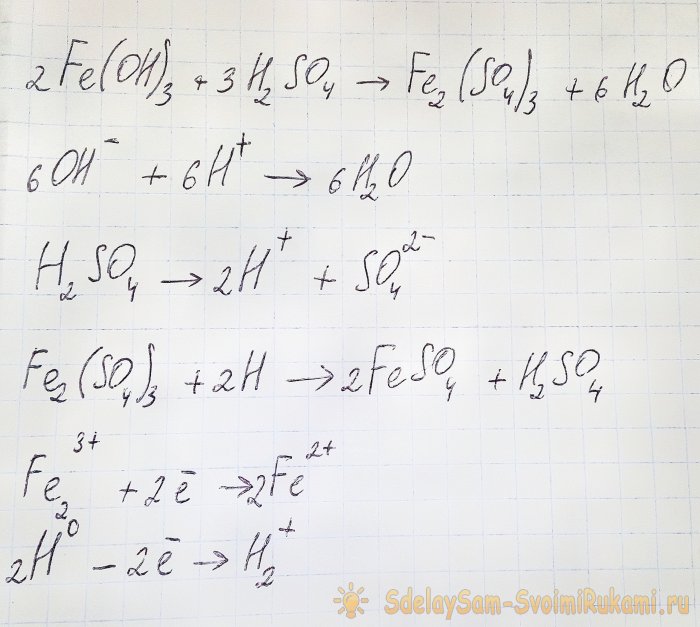Бърз начин за получаване на железен сулфат от тор
Предпоследната стъпка по пътя към получаване на благороден метал от радиокомпоненти е редуцирането на последния от съответния хлорид. Железният (II) сулфат е отличен за тези цели. Разгледайте уравнението за тази реакция:
HAuCl4 - водороден тетрахлороаурат (III) - съединение, което се образува, когато златото се разтвори в царска вода. Засега няма да навлизаме по-дълбоко в този процес, тъй като той заслужава отделна статия.
И така, сулфатът (по-нататък се има предвид железен (II) сулфат) е един от евтините и лесно достъпни редуциращи агенти. В магазините може да се намери под името "железен сулфат", това е тор. Но това не е чисто вещество, делът на сулфат в него е около 50%, останалото е примеси. И преди да можем да възстановим златото, трябва да пречистим нашия сулфат.
Ще се нуждая
За това ще ви трябва:
- Железен сулфат (продава се в магазините като „всичко за градината“, купих килограм, за да ми стигне за главата);
- Разтвор на сярна киселина, известен още като киселинен електролит за акумулатори (в автокъщите);
- Алкохол, използвах 95%;
- Химически съдове или съдове за еднократна употреба (чаши, лъжици за разбъркване).
Ние получаваме железен сулфат от тора
Използвам стъклен буркан за приготвяне на разтвора. Вътре има 500 мл топла вода, може и малко по-малко.
Сега измерете около половин чаша тор:
Както можете да видите, веществото е жълто-кафяво на цвят; такъв мръсен „сулфат“ може да се използва само по предназначение - за пръскане на растителност. Имаме други цели.
Изсипете го в буркана:
Разтворът придоби неприятен кафяв цвят. Оцветяването се дължи на реакцията на тора с вода:
Желязото в сулфата се окислява до тривалентен, а железният (III) хидроксид се утаява, което всъщност е причината за неговия цвят.
За да се получи сулфатът, който ни интересува от получените съединения, е необходимо разтворът да се подкисли със сярна киселина. Добавете на малки порции, докато разтворът се избистри.
В този случай възникват следните реакции:
Хидроксидът реагира с киселината, за да образува железен (III) сулфат (йонообменна реакция). Той от своя страна реагира с атомарния водород, който се образува при дисоциацията на сярната киселина. Последната реакция е редокс.
Сега разтворът съдържа точно сулфата, от който се нуждаем, но самият разтвор все още е мътен. Оставете го да престои и го филтрирайте, аз използвах химически филтър.
На дъното на буркана останаха неразтворими примеси:
Изплакваме го и изсипваме филтрирания разтвор в него. Много по-лек и изчистен е от оригинала.
Етиловият алкохол измества солите на двуосновните киселини от техните разтвори. Ще използваме това свойство, за да получим твърд сулфат. Добавяме алкохол към разтвора, излях 200 ml, което е равно на малко повече от половината от първоначалния обем на тора.
На дъното се появиха кристали от нашия сулфат.
Оставих разтвора за два дни, така че целият сулфат да има време да се утаи.
Първоначално можете да добавите повече алкохол, за да ускорите този процес.
Изцедете течността, като използвате потупване по дъното и леко нагряване, отделете сулфата от буркана и го изсипете върху хартиена кърпа, за да изсъхне.
След няколко часа изсипете сулфата в стъклен буркан, етикетирайте веществото и в тази форма може да се съхранява дълго време.
Тъй като кристалните хидрати се утаяват, формулата на веществото е както на снимката. Но това не ни пречи да го използваме за собствени цели, като го разтворим във вода.
Заключение
Предпазните мерки и спазването на правилата за работа с киселини са задължителни. В никакъв случай не трябва да забравяме за тях.
Чисти вещества за всички!
Подобни майсторски класове
Особено интересно
Коментари (1)