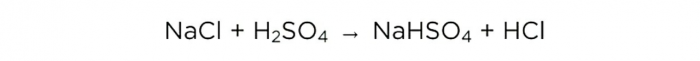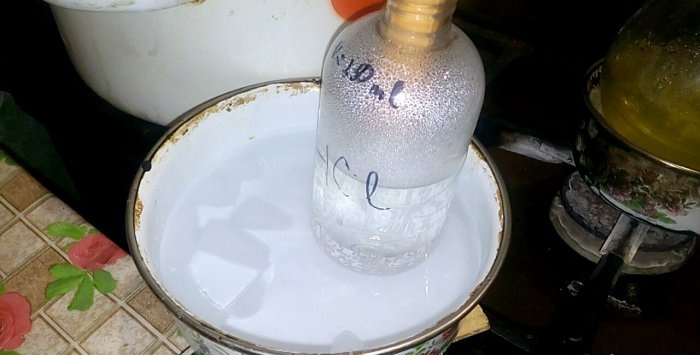صنع حمض الهيدروكلوريك في المنزل
الكيميائيون الذين أنتجوا حمض الهيدروكلوريك لأول مرة في القرن الخامس عشر أطلقوا عليه اسم "سبيريتوس ساليس"، أي "الروح من الملح". في ذلك الوقت، كان لهذا الحمض خصائص سحرية: فقد أدى إلى تآكل الورق، وإذابة المعادن، وتسمم الناس. وتبقى هذه الخصائص معه حتى يومنا هذا، ولكن الآن تمت دراسة هذا الحمض بشكل كافٍ، ولا يوجد سحر هنا.
حمض الهيدروكلوريك (HCl) هو حمض أحادي القاعدة قوي، في شكله النقي هو سائل شفاف. بتركيزه الأقصى 38% فإنه "يدخن" في الهواء. سوف نحصل على حمض بتركيز نصف ذلك.
اذا هيا بنا نبدأ.
احتياطات السلامة
كن حذرا عند العمل مع المواد السامة!
يجب إجراء جميع التجارب في غرفة جيدة التهوية أو تحت غطاء محرك السيارة، وتأكد من ارتداء نظارات السلامة (يمكن شراؤها من متجر لاجهزة الكمبيوتر) والقفازات (إذا لم تتمكن من العثور على قفازات كيميائية خاصة، فالقفازات عالية الجودة مناسبة لغسل الأطباق).
يجب أن تكون صودا الخبز موجودة في موقع التجربة لتحييد الحمض في حالة غير متوقعة (سيؤدي ذلك إلى إطلاق ثاني أكسيد الكربون والماء).
يمنع منعا باتا إجراء التجارب في الحاويات المعدنية.
سوف تحتاج
لإجراء التجربة سنحتاج إلى:
- إلكتروليت حمضي للبطاريات (يُباع في متجر السيارات)؛
- الماء المقطر (المرجع نفسه)؛
- ملح الطعام (متوفر في أي مطبخ)؛
- صودا الخبز (انظر احتياطات السلامة).
من الأطباق التي تحتاجها:
- قنينة زجاجية؛
- وعاء به رمل حيث يمكنك وضع القارورة؛
- عدة أكواب يمكن التخلص منها سعة 200 مل؛
إذا كان لديك دورق مقاوم للحرارة، يمكنك تسخينه تحت لهب الموقد المكشوف. لكنني ما زلت أوصي باستخدام الرمل، وفي هذه الحالة سوف يمتص الحمض.
ستحتاج أيضًا إلى زوج من زوايا السباكة بقطر 50 مم وموقد (في حالتي، كحول، لكنني أوصي باستخدام الغاز).
المرحلة 1 - التبخر
المنحل بالكهرباء للبطاريات هو 36٪ حمض الكبريتيك (H2SO4). أولا نحن بحاجة إلى زيادة تركيزه.
صب 200 مل في الكوب، أي حتى الحافة تقريبًا، واسكب ما يزيد قليلاً عن نصف الكوب في القارورة. ضع علامة باستخدام علامة وأضف الباقي.
وضعت عاكسًا من رقائق معدنية حول الدورق من أجل تسخين أكثر كفاءة، لكني قمت بإزالته لاحقًا لأنه بدأ في الذوبان.
الآن ضع القارورة على الموقد وتبخر إلى مستوى العلامة المحددة مسبقًا، حتى أقل قليلاً.
في نفس الوقت نضع الشاش المطوي عدة مرات على الزاوية ونثبته بشريط مطاطي. قم بإعداد محلول صودا غير مشبع واغمس فيه نهاية الزاوية بالشاش.
عندما يبدأ المنحل بالكهرباء في الغليان، نضع زاوية على القارورة، ويجلس عليها بإحكام. نوجه نهاية الشاش إلى النافذة المفتوحة.
يعد ذلك ضروريًا إذا بدأ حمض الكبريتيك نفسه فجأة في التبخر مع الماء. إذا لم تقم بتسخين الدورق أكثر من اللازم، فلن يحدث هذا.
الموقد في العمل:
الموقد الخاص بي منخفض القوة نسبيًا، لذلك استغرق التبخر حوالي ساعة.من شأن موقد الغاز أو الموقد الكهربائي أن يسرع هذه العملية بشكل كبير.
بعد الانتهاء من المرحلة الأولى، يجب أن يبقى أقل بقليل من نصف المحلول في الدورق، أي حمض بتركيز حوالي 75٪. لا تنسى الدقة.
دعها تبرد الى درجة حرارة الغرفة.
المرحلة الثانية - الحسابات
الآن بعد أن أصبح لدينا حمض الكبريتيك المركز، يمكننا إجراء التفاعل الأساسي، وهو يبدو كما يلي:
لكن أولاً، دعونا نقوم ببعض الحسابات، وفي النهاية سنقارنها بما حدث عمليًا.
لذا، في البداية كان لدينا 200 مل من الإلكتروليت بكثافة 1.27 جم/سم مكعب. وبالنظر إلى جدول كثافات حامض الكبريتيك نرى أن هذه الكثافة تقابل تركيز 36%. دعونا نحسب حجم الحمض:
200 مل * 36٪ = 72 مل - V (H2SO4)
وبعد أن قمنا بتبخير المحلول، زاد تركيزه، وبالتالي كثافته. ننظر إلى نفس الجدول ونرى أن التركيز 75% يقابل كثافة 1.67 جم/سم3.
بمعرفة الكثافة الحالية (p) والحجم (V) للحمض، نكتشف الكتلة:
م=ص*الخامس;
م (H2SO4) = 1.67 جم / سم مكعب * 72 مل = 120 جم ؛
م (H2SO4) = 1.67 جم / سم مكعب * 72 مل = 120 جم ؛
الآن نتذكر من الكيمياء المدرسية:
م (H2SO4) / M (H2SO4) = م (كلوريد الصوديوم) / M (كلوريد الصوديوم) = م (حمض الهيدروكلوريك) / M (حمض الهيدروكلوريك)،
حيث M هي الكتلة المولية للمادة.
حيث M هي الكتلة المولية للمادة.
الكتل المولية لـ H2SO4 وNaCl وHCl هي 98 و58.5 و36.5 جم/مول على التوالي. يمكننا الآن معرفة كمية ملح الطعام المطلوبة وكمية حمض الهيدروكلوريك التي سنحصل عليها.
أي أننا نحتاج إلى 72 جرامًا من كلوريد الصوديوم، أي 34 مل، فلنأخذ الكمية الزائدة - ربع كوب.
عظيم، وحمض الهيدروكلوريك من الناحية النظرية سوف يصل إلى 44.7 غرام.
يحتوي جدول كثافة حمض الهيدروكلوريك على عمود g/l. نأخذ من هناك قيمة التركيز 15% - 166.4 جم/لتر. حجم الماء المطلوب للحصول على 15% حمض الهيدروكلوريك هو 44.7/166.4≈270 مل. سنأخذ 200 مل. ونتيجة لذلك، من الناحية النظرية، سأحصل على 22٪ حمض الهيدروكلوريك.
المرحلة 3 - الحصول على الحمض
نقوم بتوصيل الزاويتين على النحو التالي:
وسيبدو الهيكل بأكمله كما يلي:
سوف يتكثف الحمض المقابل في وعاء يسمى حمض الهيدروكلوريك (HCl)، حجم الماء فيه هو 200 مل. ضع علامة أيضًا على مستوى السائل الحالي في هذه الحاوية.
نزيل الزوايا ونسكب الكمية المحسوبة من الملح في القارورة من خلال القمع.
يتحول الحل إلى اللون الأصفر.
من أجل إطلاق حمض الهيدروكلوريك، تحتاج إلى تشغيل الموقد. لكن أولاً نربط الزوايا بإحكام بالقارورة والسفينة المستقبلة.
عندما يتكثف الحمض في الماء، تتشكل "موجات عمودية". كما يتم تسخين المحلول ويجب تبريده. على سبيل المثال، يمكنك وضع سفينة أخرى مع الجليد أدناه.
يستمر التفاعل بسرعة نسبيا - 20 دقيقة، وبعد ذلك يمكنك إيقاف النار. دع الأبخرة الأخيرة من حمض الهيدروكلوريك تذوب في الماء، ثم أغلق الوعاء بإحكام. عندما تبرد القارورة، قم بتخفيف المحلول المتبقي بالماء (حوالي واحد إلى واحد) واسكبه في المجاري.
الحد الأدنى
من خلال العلامة الموجودة على الوعاء نحدد مقدار السائل الذي تمت إضافته. بالنسبة لي هو ⅙، أي 17%. هذا هو تركيز حمض الهيدروكلوريك. دعونا نقارنها مع تلك التي تم الحصول عليها من الناحية النظرية.
17%/22%*100%=77% - ناتج التفاعل.
ومن المهم ملاحظة أنه لا يوجد ناتج يساوي 1، فهناك دائمًا خسائر. في حالتي، هذا المنحل بالكهرباء لم يتبخر بشكل كاف. من الناحية المثالية، يجب أن يكون تركيز حمض الكبريتيك 90-95٪.
دعونا نتحقق من تفاعل الحمض الناتج مع المعدن.
نلاحظ التطور السريع للهيدروجين. وهذا يعني أن الحمض مناسب لمزيد من التجارب.
الاختلافات
يمكنك استخدام زجاجة بيرة أو صودا زجاجية نظيفة كقارورة، لكن بشرط أن يكون التسخين سلسًا قدر الإمكان. بدلا من الزوايا البلاستيكية، يمكنك أن تأخذ أنابيب البولي بروبلين وزوايا قطر أصغر (مناسبة لقارورة الخاص بك).
مرة أخرى، أحثكم على اتباع احتياطات السلامة. تجارب سعيدة للجميع!
فصول رئيسية مماثلة
مثيرة للاهتمام بشكل خاص
التعليقات (19)