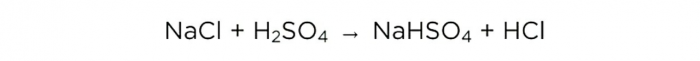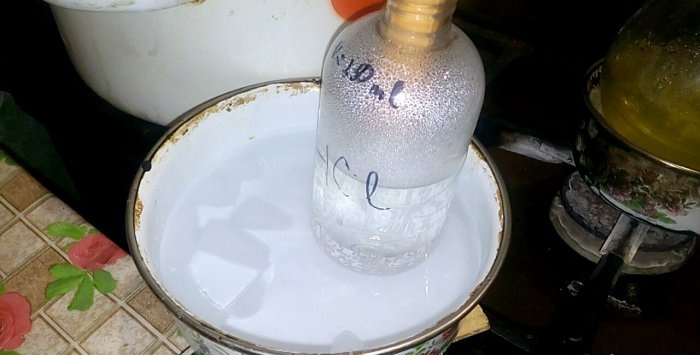Elaboració d'àcid clorhídric a casa
Els alquimistes que van produir àcid clorhídric per primera vegada al segle XV l'anomenaven "spiritus salis", "esperit de la sal". En aquella època, aquest àcid tenia propietats màgiques: corroia el paper, dissolva metalls i enverinava les persones. Aquestes propietats es mantenen fins als nostres dies, però ara aquest àcid ha estat prou estudiat i aquí no hi ha màgia.
L'àcid clorhídric (HCl) és un àcid monobàsic fort, en la seva forma pura és un líquid transparent. A la seva màxima concentració del 38% "fuma" a l'aire. Rebrem àcid amb una concentració de la meitat.
Així que comencem.
Precaucions de seguretat
Aneu amb compte quan treballeu amb substàncies tòxiques!
Tots els experiments s'han de dur a terme en una habitació ben ventilada o sota una caputxa. Assegureu-vos de portar ulleres de seguretat (es poden comprar a una ferreteria) i guants (si no trobeu guants químics especials, són adequats els de bona qualitat). per rentar els plats).
El bicarbonat de sodi ha d'estar present al lloc de l'experiment per neutralitzar l'àcid en una situació imprevista (això alliberarà diòxid de carboni i aigua).
Està estrictament prohibit fer experiments en recipients metàl·lics.
Necessitarem
Per dur a terme l'experiment necessitarem:
- Electròlit àcid per a bateries (es ven en una botiga de cotxes);
- Aigua destil·lada (ibid);
- Sal de taula (disponible a qualsevol cuina);
- Bicarbonat de sodi (vegeu precaucions de seguretat).
Dels plats que necessiteu:
- matràs de vidre;
- Un recipient amb sorra on posar el matràs;
- Diversos gots d'un sol ús de 200 ml;
Si teniu un matràs resistent a la calor, podeu escalfar-lo sota la flama oberta d'un cremador. Però tot i així recomano utilitzar sorra, en aquest cas absorbirà l'àcid.
També necessitareu un parell d'angles de fontaneria amb un diàmetre de 50 mm i un cremador (en el meu cas, alcohol, però us recomano utilitzar un de gas).
Etapa 1 - evaporació
L'electròlit de les bateries és un 36% d'àcid sulfúric (H2SO4). Primer hem d'augmentar la seva concentració.
Aboqueu 200 ml al got, és a dir, quasi de gom a gom, i aboqueu una mica més de la meitat del got al matràs. Feu una marca amb un retolador i afegiu la resta.
Vaig col·locar un reflector d'alumini al voltant del matràs per a un escalfament més eficient, però més tard el vaig treure perquè es va començar a fondre.
Ara poseu el matràs al cremador i evaporeu fins al nivell de la marca prèviament fixada, encara que sigui una mica més baix.
Al mateix temps, posem una gasa doblegada diverses vegades a la cantonada i la fixem amb una goma elàstica. Prepareu una solució de refresc insaturat i submergiu-hi l'extrem de la cantonada amb una gasa.
Quan l'electròlit comenci a bullir, posem un racó al matràs, s'hi assenta ben fort. Dirigim l'extrem de la gasa a la finestra oberta.
Això és necessari si de sobte el propi àcid sulfúric comença a evaporar-se juntament amb l'aigua. Si no sobreescalfeu massa el matràs, això no passarà.
Cremador en acció:
El meu cremador té una potència relativament baixa, de manera que l'evaporació va trigar aproximadament una hora.Un cremador de gas o una estufa elèctrica acceleraria significativament aquest procés.
Després de completar la primera etapa, ha de quedar una mica menys de la meitat de la solució al matràs, és a dir, un àcid amb una concentració d'aproximadament el 75%. No us oblideu de la precisió.
Deixeu-ho refredar a temperatura ambient.
Etapa 2 - càlculs
Ara que tenim àcid sulfúric concentrat, podem dur a terme la reacció bàsica, té aquest aspecte:
Però primer, fem alguns càlculs i, al final, els compararem amb el que va passar a la pràctica.
Així doncs, inicialment teníem 200 ml d'electròlit amb una densitat d'1,27 g/cm³. Observant la taula de densitats de l'àcid sulfúric, veiem que aquesta densitat correspon a una concentració del 36%. Calculem el volum d'àcid:
200 ml * 36% = 72 ml - V (H2SO4)
Després d'evaporar la solució, va augmentar la seva concentració i, per tant, la seva densitat. Observem la mateixa taula i veiem que una concentració del 75% correspon a una densitat d'1,67 g/cm³.
Coneixent la densitat de corrent (p) i el volum (V) de l'àcid, trobem la massa:
m=p*V;
m(H2SO4)=1,67g/cm³ * 72ml=120g;
m(H2SO4)=1,67g/cm³ * 72ml=120g;
Ara recordem de la química de l'escola:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
on M és la massa molar de la substància.
on M és la massa molar de la substància.
Les masses molars de H2SO4, NaCl i HCl són 98, 58,5 i 36,5 g/mol, respectivament. Ara podem esbrinar quanta sal de taula es necessita i quant HCl obtindrem.
És a dir, necessitem 72 g de NaCl, és a dir, 34 ml, prenem-lo en excés: un quart de got.
Genial, i l'HCl en teoria sortirà a 44,7 g.
La taula de densitat d'HCl té una columna de g/l. Prenem d'aquí el valor d'una concentració del 15% - 166,4 g/l. El volum d'aigua necessari per obtenir HCl al 15% és de 44,7/166,4≈270ml. Prenem 200 ml. Com a resultat, en teoria, obtindré un 22% d'àcid clorhídric.
Etapa 3 - obtenció d'àcid
Connectem les dues cantonades de la següent manera:
I tota l'estructura quedarà així:
L'àcid corresponent es condensarà en un recipient marcat amb HCl; el volum d'aigua en ell és de 200 ml. Marqueu també el nivell de líquid actual en aquest recipient.
Traiem les cantonades i aboquem la quantitat de sal calculada al matràs a través d'un embut.
La solució es torna groga.
Perquè l'àcid clorhídric comenci a alliberar-se, cal encendre el cremador. Però primer, connectem amb força les cantonades al matràs i al recipient receptor.
Quan l'àcid es condensa a l'aigua, es formen "ones verticals". A més, la solució s'escalfa i s'ha de refredar. Per exemple, podeu col·locar un altre vaixell amb gel a sota.
La reacció transcorre relativament ràpidament: 20 minuts, després dels quals podeu apagar el foc. Deixeu que els últims vapors d'àcid clorhídric es dissolguin a l'aigua, i després tanqueu el recipient hermèticament. Quan el matràs s'hagi refredat, diluïu la solució restant amb aigua (aproximadament un a un) i aboqueu-la al clavegueram.
Linia inferior
Per la marca del recipient determinem quant líquid s'ha afegit. Per a mi és ⅙, és a dir, un 17%. Aquesta és la concentració del nostre àcid clorhídric. Comparem-ho amb l'obtingut en teoria.
17%/22%*100%=77% - rendiment de la reacció.
És important tenir en compte que no hi ha una sortida igual a 1, sempre hi ha pèrdues. En el meu cas, es tracta d'un electròlit insuficientment evaporat. Idealment, la concentració d'àcid sulfúric hauria de ser del 90-95%.
Comprovem l'àcid resultant per a la interacció amb el metall.
Observem una ràpida evolució de l'hidrogen. Això significa que l'àcid és adequat per a més experiments.
Variacions
Podeu utilitzar una ampolla de vidre neta de cervesa o refresc com a matràs, però sempre que l'escalfament sigui el més suau possible. En lloc de cantonades de PVC, podeu agafar canonades de polipropilè i cantonades de menor diàmetre (adequades per al vostre matràs).
Un cop més us demano que seguiu les mesures de seguretat. Bones experiències a tothom!
Classes magistrals similars
Particularment interessant
Comentaris (19)