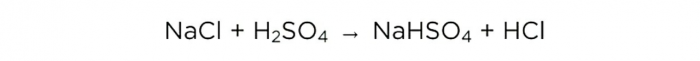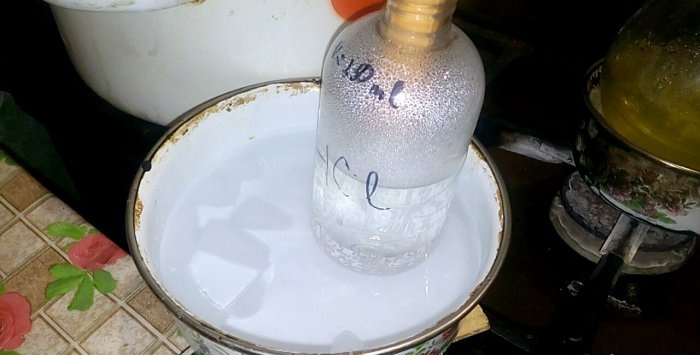Výroba kyseliny chlorovodíkové doma
Alchymisté, kteří v 15. století jako první vyrobili kyselinu chlorovodíkovou, ji nazývali „spiritus salis“, „duch ze soli“. V té době měla tato kyselina magické vlastnosti: korodovala papír, rozpouštěla kovy a otravovala lidi. Tyto vlastnosti jí zůstávají dodnes, ale nyní je tato kyselina dostatečně prozkoumána a žádná magie zde neexistuje.
Kyselina chlorovodíková (HCl) je silná jednosytná kyselina, v čisté formě je to průhledná kapalina. Při maximální koncentraci 38 % „kouří“ ve vzduchu. Kyselinu dostaneme o poloviční koncentraci.
Pojďme tedy začít.
Bezpečnostní opatření
Buďte opatrní při práci s toxickými látkami!
Všechny pokusy musí být prováděny v dobře větrané místnosti nebo pod digestoří, používejte ochranné brýle (lze zakoupit v železářství) a rukavice (pokud neseženete speciální chemické rukavice, vhodné jsou kvalitní na mytí nádobí).
V místě pokusu musí být přítomna jedlá soda, aby se kyselina v nepředvídané situaci neutralizovala (uvolní se tak oxid uhličitý a voda).
Je přísně zakázáno provádět experimenty v kovových nádobách.
Bude potřeba
K provedení experimentu budeme potřebovat:
- Kyselý elektrolyt pro baterie (prodává se v obchodě s automobily);
- Destilovaná voda (tamtéž);
- Kuchyňská sůl (k dispozici v každé kuchyni);
- Jedlá soda (viz bezpečnostní opatření).
Z nádobí, které potřebujete:
- Skleněná baňka;
- Nádoba s pískem, kam můžete umístit baňku;
- Několik jednorázových kelímků 200 ml;
Pokud máte žáruvzdornou baňku, můžete ji zahřát pod otevřeným plamenem hořáku. Ale přesto doporučuji použít písek, v takovém případě bude absorbovat kyselinu.
Dále budete potřebovat pár klempířských úhelníků o průměru 50mm a hořák (v mém případě lihový, ale doporučuji použít plynový).
Fáze 1 - odpařování
Elektrolytem pro baterie je 36% kyselina sírová (H2SO4). Nejprve musíme zvýšit jeho koncentraci.
Do sklenice nalijte 200 ml, tedy téměř po okraj, a do baňky nalijte o něco více než polovinu sklenice. Udělejte značku fixem a přidejte zbytek.
Kolem baňky jsem umístil fóliový reflektor pro účinnější ohřev, ale později jsem ho odstranil, protože se začal tavit.
Nyní položte baňku na hořák a odpařte na úroveň dříve nastavené značky, ještě o něco níže.
Současně na roh položíme několikrát přeloženou gázu a zajistíme gumičkou. Připravte si nenasycený roztok sody a ponořte do něj konec rohu s gázou.
Když se elektrolyt začne vařit, přiložíme roh na baňku, pevně na ní sedí. Konec gázy nasměrujeme do otevřeného okna.
To je nutné, pokud se náhle začne odpařovat samotná kyselina sírová spolu s vodou. Pokud baňku příliš nepřehříváte, nestane se to.
Hořák v akci:
Můj hořák má relativně nízký příkon, takže odpařování trvalo asi hodinu.Plynový hořák nebo elektrický sporák by tento proces výrazně urychlily.
Po dokončení prvního stupně by v baňce měla zůstat o něco méně než polovina roztoku, tj. kyselina o koncentraci asi 75 %. Nezapomeňte na přesnost.
Nechte vychladnout na pokojovou teplotu.
Fáze 2 - výpočty
Nyní, když máme koncentrovanou kyselinu sírovou, můžeme provést základní reakci, která vypadá takto:
Nejprve si ale udělejme nějaké výpočty a na závěr je porovnáme s tím, co se stalo v praxi.
Takže zpočátku jsme měli 200 ml elektrolytu o hustotě 1,27 g/cm³. Při pohledu na tabulku hustot kyseliny sírové vidíme, že tato hustota odpovídá koncentraci 36 %. Vypočítejme objem kyseliny:
200 ml*36%=72ml - V(H2SO4)
Poté, co jsme roztok odpařili, jeho koncentrace a tím i hustota vzrostla. Podíváme se na stejnou tabulku a vidíme, že koncentrace 75 % odpovídá hustotě 1,67 g/cm³.
Když známe hustotu proudu (p) a objem (V) kyseliny, zjistíme hmotnost:
m=p*V;
m(H2SO4)=1,67g/cm3*72ml=120g;
m(H2SO4)=1,67g/cm3*72ml=120g;
Nyní si pamatujeme ze školní chemie:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
kde M je molární hmotnost látky.
kde M je molární hmotnost látky.
Molární hmotnosti H2SO4, NaCl a HCl jsou 98, 58,5 a 36,5 g/mol. Nyní můžeme zjistit, kolik kuchyňské soli je potřeba a kolik HCl získáme.
Konkrétně potřebujeme 72 g NaCl, to je 34 ml, vezměme ho v přebytku - čtvrt sklenice.
Skvělé a HCl teoreticky vyjde na 44,7 g.
Hustotní tabulka HCl má sloupec g/l. Odtud bereme hodnotu pro koncentraci 15 % - 166,4 g/l. Objem vody potřebný k získání 15% HCl je 44,7/166,4≈270 ml. Odebereme 200 ml. V důsledku toho teoreticky dostanu 22% kyselinu chlorovodíkovou.
Fáze 3 - získání kys
Oba rohy spojíme následovně:
A celá struktura bude vypadat takto:
Odpovídající kyselina zkondenzuje do nádobky označené HCl, objem vody v ní je 200 ml. Na této nádobě si také označte aktuální hladinu kapaliny.
Odstraníme rohy a přes nálevku nasypeme do baňky vypočítané množství soli.
Roztok zežloutne.
Aby se kyselina chlorovodíková začala uvolňovat, musíte zapnout hořák. Nejprve však pevně připevníme rohy k baňce a přijímací nádobě.
Když kyselina kondenzuje ve vodě, tvoří se „svislé vlny“. Roztok se také zahřívá a musí být ochlazen. Dole můžete například umístit další nádobu s ledem.
Reakce probíhá poměrně rychle - 20 minut, poté můžete teplo vypnout. Nechte ve vodě rozpustit poslední výpary kyseliny chlorovodíkové a poté nádobu hermeticky uzavřete. Po vychladnutí baňky zřeďte zbývající roztok vodou (přibližně jedna ku jedné) a nalijte do kanalizace.
Sečteno a podtrženo
Podle značky na nádobě určíme, kolik tekutiny bylo přidáno. U mě je to ⅙, tedy 17 %. Toto je koncentrace naší kyseliny chlorovodíkové. Srovnejme to s tím získaným teoreticky.
17 %/22 % x 100 % = 77 % - výtěžek reakce.
Je důležité si uvědomit, že neexistuje žádný výstup rovný 1, vždy jsou ztráty. V mém případě se jedná o nedostatečně odpařený elektrolyt. V ideálním případě by koncentrace kyseliny sírové měla být 90-95%.
Zkontrolujme výslednou kyselinu na interakci s kovem.
Pozorujeme rychlý vývoj vodíku. To znamená, že kyselina je vhodná pro další experimenty.
Variace
Jako baňku můžete použít čistou skleněnou láhev od piva nebo sody, ale za předpokladu, že ohřev bude co nejhladší. Místo PVC rohů můžete vzít polypropylenové trubky a rohy menšího průměru (vhodné pro vaši baňku).
Ještě jednou vás žádám, abyste dodržovali bezpečnostní opatření. Veselé zážitky všem!
Podobné mistrovské kurzy
Zvláště zajímavé
Komentáře (19)