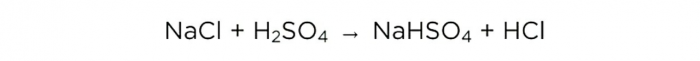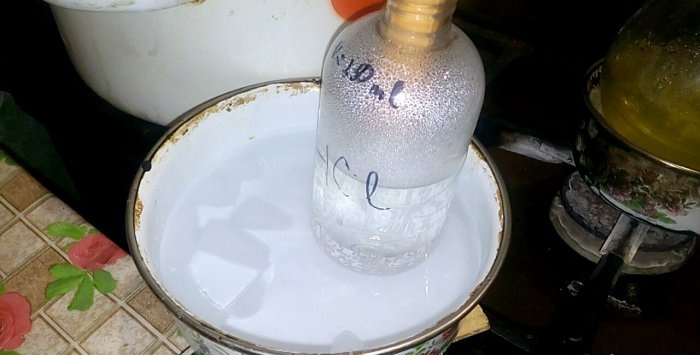At lave saltsyre derhjemme
Alkymister, der først producerede saltsyre i det 15. århundrede, kaldte det "spiritus salis", "ånd fra salt." På det tidspunkt havde denne syre magiske egenskaber: den tærede papir, opløste metaller og forgiftede mennesker. Disse egenskaber forbliver med den til i dag, men nu er denne syre blevet tilstrækkeligt undersøgt, og der er ingen magi her.
Saltsyre (HCl) er en stærk monobasisk syre, i sin rene form er det en gennemsigtig væske. Ved sin maksimale koncentration på 38 % "ryger" den i luften. Vi vil modtage syre med en koncentration på det halve.
Så lad os komme i gang.
Sikkerhedsforanstaltninger
Vær forsigtig, når du arbejder med giftige stoffer!
Alle forsøg skal udføres i et godt ventileret rum eller under emhætte Sørg for at bære sikkerhedsbriller (kan købes i en byggemarked) og handsker (hvis du ikke kan finde specielle kemikaliehandsker, er en god kvalitet velegnet til opvask).
Bagepulver skal være til stede på forsøgsstedet for at neutralisere syren i en uforudset situation (dette vil frigive kuldioxid og vand).
Det er strengt forbudt at udføre eksperimenter i metalbeholdere.
Vil behøve
For at udføre eksperimentet skal vi bruge:
- Syreelektrolyt til batterier (sælges i en bilforretning);
- Destilleret vand (ibid);
- Bordsalt (tilgængelig i ethvert køkken);
- Bagepulver (se sikkerhedsforanstaltninger).
Fra retterne skal du bruge:
- Glaskolbe;
- Et kar med sand, hvor du kan placere kolben;
- Flere engangskopper 200 ml;
Hvis du har en varmebestandig kolbe, kan du varme den op under åben ild i en brænder. Men jeg anbefaler stadig at bruge sand, i så fald vil det absorbere syre.
Du skal også bruge et par VVS-vinkler med en diameter på 50 mm og en brænder (i mit tilfælde alkohol, men jeg anbefaler at bruge en gas).
Fase 1 - fordampning
Elektrolytten til batterier er 36 % svovlsyre (H2SO4). Først skal vi øge dens koncentration.
Hæld 200 ml i glasset, det vil sige næsten til randen, og hæld lidt mere end halvdelen af glasset i kolben. Lav et mærke med en markør og tilføj resten.
Jeg placerede en foliereflektor rundt om kolben for mere effektiv opvarmning, men fjernede den senere, fordi den begyndte at smelte.
Sæt nu kolben på brænderen og inddamp til niveauet for det tidligere indstillede mærke, endda lidt lavere.
Samtidig lægger vi gaze foldet flere gange på hjørnet og fastgør det med et elastikbånd. Forbered en umættet sodavandsopløsning og dyp enden af hjørnet med gaze ind i den.
Når elektrolytten begynder at koge, sætter vi et hjørne på kolben, den sidder tæt på den. Vi leder gazeenden ind i det åbne vindue.
Dette er nødvendigt, hvis selve svovlsyren pludselig begynder at fordampe sammen med vandet. Hvis du ikke overopvarmer kolben for meget, sker det ikke.
Brænder i aktion:
Min brænder har relativt lav watt, så fordampningen tog omkring en time.En gasbrænder eller elektrisk komfur ville fremskynde denne proces betydeligt.
Efter at have afsluttet det første trin skal lidt mindre end halvdelen af opløsningen forblive i kolben, det vil sige en syre med en koncentration på omkring 75%. Glem ikke nøjagtigheden.
Lad det afkøle til stuetemperatur.
Fase 2 - beregninger
Nu hvor vi har koncentreret svovlsyre, kan vi udføre den grundlæggende reaktion, den ser sådan ud:
Men lad os først lave nogle beregninger, og til sidst vil vi sammenligne dem med, hvad der skete i praksis.
Så oprindeligt havde vi 200 ml elektrolyt med en densitet på 1,27 g/cm³. Ser vi på tabellen over densiteter af svovlsyre, ser vi, at denne densitet svarer til en koncentration på 36%. Lad os beregne volumen af syre:
200ml*36%=72ml - V(H2SO4)
Efter at vi fordampede opløsningen, steg dens koncentration, og derfor dens massefylde. Vi ser på samme tabel og ser, at en koncentration på 75 % svarer til en massefylde på 1,67 g/cm³.
Ved at kende syrens strømtæthed (p) og volumen (V) finder vi ud af massen:
m=p*V;
m(H2S04) = 1,67 g/cm3 * 72 ml = 120 g;
m(H2S04) = 1,67 g/cm3 * 72 ml = 120 g;
Nu husker vi fra skolens kemi:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
hvor M er stoffets molære masse.
hvor M er stoffets molære masse.
Molmasserne af H2SO4, NaCl og HCl er henholdsvis 98, 58,5 og 36,5 g/mol. Nu kan vi finde ud af, hvor meget bordsalt der skal til, og hvor meget HCl vi får.
Vi har nemlig brug for 72 g NaCl, det er 34 ml, lad os tage det i overskud - et kvart glas.
Fantastisk, og HCl vil i teorien komme ud til 44,7 g.
HCl-densitetstabellen har en g/l kolonne. Vi tager derfra værdien for en koncentration på 15% - 166,4 g/l. Det nødvendige volumen af vand for at opnå 15 % HCl er 44,7/166,4≈270 ml. Vi tager 200 ml. Som et resultat vil jeg i teorien få 22% saltsyre.
Trin 3 - opnåelse af syre
Vi forbinder de to hjørner som følger:
Og hele strukturen vil se sådan ud:
Den tilsvarende syre vil kondensere til en beholder mærket HCl; rumfanget af vand i den er 200 ml. Marker også det aktuelle væskeniveau på denne beholder.
Vi fjerner hjørnerne og hælder den beregnede mængde salt i kolben gennem en tragt.
Opløsningen bliver gul.
For at saltsyre begynder at frigives, skal du tænde for brænderen. Men først fastgør vi hjørnerne tæt til kolben og det modtagende fartøj.
Når syre kondenserer i vand, dannes "lodrette bølger". Også opløsningen opvarmes og skal afkøles. For eksempel kan du placere et andet fartøj med is nedenfor.
Reaktionen forløber relativt hurtigt - 20 minutter, hvorefter du kan slukke for varmen. Lad de sidste dampe af saltsyre opløses i vandet, og forsegl derefter beholderen hermetisk. Når kolben er afkølet, fortynd den resterende opløsning med vand (ca. en til en) og hæld den i kloakken.
Bundlinie
Ved mærket på beholderen bestemmer vi, hvor meget væske der er tilsat. For mig er det ⅙, det vil sige 17%. Dette er koncentrationen af vores saltsyre. Lad os sammenligne den med den opnåede i teorien.
17%/22%*100%=77% - reaktionsudbytte.
Det er vigtigt at bemærke, at der ikke er noget output svarende til 1, der er altid tab. I mit tilfælde er dette en utilstrækkeligt fordampet elektrolyt. Ideelt set bør koncentrationen af svovlsyre være 90-95%.
Lad os kontrollere den resulterende syre for interaktion med metal.
Vi observerer hurtig udvikling af brint. Det betyder, at syren er velegnet til yderligere forsøg.
Variationer
Du kan bruge en ren glasflaske øl eller sodavand som en kolbe, men forudsat at opvarmningen er så jævn som muligt. I stedet for PVC-hjørner kan du tage polypropylenrør og hjørner med en mindre diameter (egnet til din kolbe).
Endnu en gang opfordrer jeg dig til at følge sikkerhedsforanstaltningerne. Gode oplevelser alle sammen!
Lignende mesterklasser
Særlig interessant
Kommentarer (19)