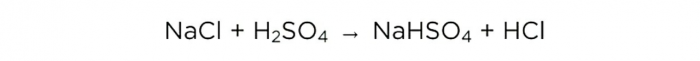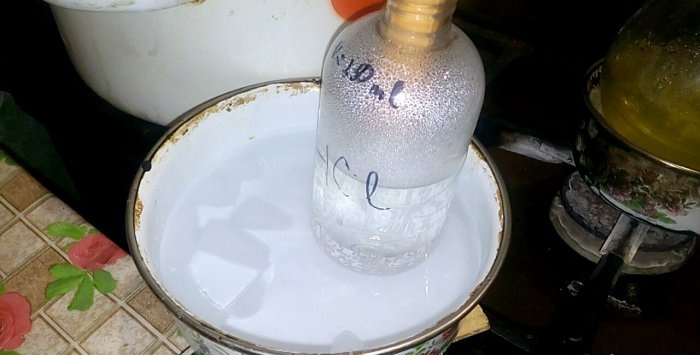Κατασκευή υδροχλωρικού οξέος στο σπίτι
Οι αλχημιστές που παρήγαγαν για πρώτη φορά υδροχλωρικό οξύ τον 15ο αιώνα το ονόμασαν «spiritus salis», «πνεύμα από αλάτι». Εκείνη την εποχή, αυτό το οξύ είχε μαγικές ιδιότητες: διάβρωνε το χαρτί, διέλυε μέταλλα και δηλητηρίαζε ανθρώπους. Αυτές οι ιδιότητες παραμένουν μαζί του μέχρι σήμερα, αλλά τώρα αυτό το οξύ έχει μελετηθεί επαρκώς και δεν υπάρχει μαγεία εδώ.
Το υδροχλωρικό οξύ (HCl) είναι ένα ισχυρό μονοβασικό οξύ, στην καθαρή του μορφή είναι ένα διαφανές υγρό. Στη μέγιστη συγκέντρωση του 38% «καπνίζει» στον αέρα. Θα λάβουμε οξύ με συγκέντρωση μισή αυτής.
Ας ξεκινήσουμε λοιπόν.
Μέτρα ασφαλείας
Να είστε προσεκτικοί όταν εργάζεστε με τοξικές ουσίες!
Όλα τα πειράματα πρέπει να διεξάγονται σε καλά αεριζόμενο δωμάτιο ή κάτω από κουκούλα. Φροντίστε να φοράτε γυαλιά ασφαλείας (μπορείτε να αγοράσετε σε κατάστημα υλικού) και γάντια (αν δεν μπορείτε να βρείτε ειδικά χημικά γάντια, είναι κατάλληλα καλής ποιότητας για το πλύσιμο των πιάτων).
Πρέπει να υπάρχει μαγειρική σόδα στο σημείο του πειράματος προκειμένου να εξουδετερωθεί το οξύ σε μια απρόβλεπτη κατάσταση (αυτό θα απελευθερώσει διοξείδιο του άνθρακα και νερό).
Απαγορεύεται αυστηρά η διεξαγωγή πειραμάτων σε μεταλλικά δοχεία.
Θα χρειαστεί
Για να πραγματοποιήσουμε το πείραμα θα χρειαστούμε:
- Οξινός ηλεκτρολύτης για μπαταρίες (πωλείται σε κατάστημα αυτοκινήτων).
- Απεσταγμένο νερό (ibid);
- Επιτραπέζιο αλάτι (διατίθεται σε οποιαδήποτε κουζίνα).
- Μαγειρική σόδα (βλ. προφυλάξεις ασφαλείας).
Από τα πιάτα που χρειάζεστε:
- Γυάλινη φιάλη;
- Ένα δοχείο με άμμο όπου μπορείτε να τοποθετήσετε τη φιάλη.
- Πολλά ποτήρια μιας χρήσης 200 ml.
Εάν έχετε μια ανθεκτική στη θερμότητα φιάλη, μπορείτε να τη θερμάνετε κάτω από την ανοιχτή φλόγα ενός καυστήρα. Αλλά εξακολουθώ να προτείνω τη χρήση άμμου, οπότε θα απορροφήσει το οξύ.
Θα χρειαστείτε επίσης ένα ζευγάρι γωνίες υδραυλικών με διάμετρο 50 mm και καυστήρα (στην περίπτωσή μου, αλκοόλ, αλλά προτείνω τη χρήση αερίου).
Στάδιο 1 - εξάτμιση
Ο ηλεκτρολύτης για τις μπαταρίες είναι 36% θειικό οξύ (H2SO4). Πρώτα πρέπει να αυξήσουμε τη συγκέντρωσή του.
Ρίξτε 200 ml στο ποτήρι, δηλαδή σχεδόν μέχρι το χείλος, και ρίξτε λίγο περισσότερο από το μισό ποτήρι στη φιάλη. Κάντε ένα σημάδι με ένα μαρκαδόρο και προσθέστε το υπόλοιπο.
Τοποθέτησα έναν ανακλαστήρα αλουμινίου γύρω από τη φιάλη για πιο αποτελεσματική θέρμανση, αλλά αργότερα τον αφαίρεσα γιατί άρχισε να λιώνει.
Τώρα βάλτε τη φιάλη στον καυστήρα και εξατμίστε στο επίπεδο της προηγουμένως καθορισμένης ένδειξης, ακόμη και λίγο χαμηλότερα.
Ταυτόχρονα, βάζουμε διπλωμένη γάζα πολλές φορές στη γωνία και τη στερεώνουμε με μια ελαστική ταινία. Ετοιμάστε ένα ακόρεστο διάλυμα σόδας και βυθίστε το άκρο της γωνίας με γάζα μέσα σε αυτό.
Όταν ο ηλεκτρολύτης αρχίσει να βράζει, βάζουμε μια γωνία στη φιάλη, κάθεται σφιχτά πάνω της. Κατευθύνουμε το άκρο της γάζας στο ανοιχτό παράθυρο.
Αυτό είναι απαραίτητο εάν ξαφνικά το ίδιο το θειικό οξύ αρχίσει να εξατμίζεται μαζί με το νερό. Εάν δεν υπερθερμάνετε τη φιάλη πολύ, αυτό δεν θα συμβεί.
Καυστήρας σε δράση:
Ο καυστήρας μου είναι σχετικά χαμηλής ισχύος, οπότε η εξάτμιση κράτησε περίπου μία ώρα.Ένας καυστήρας αερίου ή μια ηλεκτρική κουζίνα θα επιτάχυνε σημαντικά αυτή τη διαδικασία.
Μετά την ολοκλήρωση του πρώτου σταδίου, λίγο λιγότερο από το μισό του διαλύματος θα πρέπει να παραμείνει στη φιάλη, δηλαδή ένα οξύ με συγκέντρωση περίπου 75%. Μην ξεχνάτε την ακρίβεια.
Αφήστε το να κρυώσει σε θερμοκρασία δωματίου.
Στάδιο 2 - υπολογισμοί
Τώρα που έχουμε συμπυκνωμένο θειικό οξύ, μπορούμε να πραγματοποιήσουμε τη βασική αντίδραση, μοιάζει με αυτό:
Αλλά πρώτα, ας κάνουμε μερικούς υπολογισμούς και στο τέλος θα τους συγκρίνουμε με αυτό που συνέβη στην πράξη.
Έτσι, αρχικά είχαμε 200 ml ηλεκτρολύτη με πυκνότητα 1,27 g/cm³. Βλέποντας τον πίνακα με τις πυκνότητες του θειικού οξέος, βλέπουμε ότι η πυκνότητα αυτή αντιστοιχεί σε συγκέντρωση 36%. Ας υπολογίσουμε τον όγκο του οξέος:
200ml*36%=72ml - V(H2SO4)
Αφού εξατμίσαμε το διάλυμα, η συγκέντρωσή του, άρα και η πυκνότητά του, αυξήθηκε. Βλέπουμε τον ίδιο πίνακα και βλέπουμε ότι μια συγκέντρωση 75% αντιστοιχεί σε πυκνότητα 1,67 g/cm³.
Γνωρίζοντας την πυκνότητα ρεύματος (p) και τον όγκο (V) του οξέος, βρίσκουμε τη μάζα:
m=p*V;
m(H2SO4)=1,67g/cm³ * 72ml=120g;
m(H2SO4)=1,67g/cm³ * 72ml=120g;
Τώρα θυμόμαστε από τη σχολική χημεία:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
όπου M είναι η μοριακή μάζα της ουσίας.
όπου M είναι η μοριακή μάζα της ουσίας.
Οι μοριακές μάζες των H2SO4, NaCl και HCl είναι 98, 58,5 και 36,5 g/mol, αντίστοιχα. Τώρα μπορούμε να μάθουμε πόσο επιτραπέζιο αλάτι χρειάζεται και πόσο HCl θα πάρουμε.
Δηλαδή, χρειαζόμαστε 72 g NaCl, δηλαδή 34 ml, ας το πάρουμε σε περίσσεια - ένα τέταρτο του ποτηριού.
Υπέροχο και το HCl θεωρητικά θα βγει στα 44,7 γρ.
Ο πίνακας πυκνότητας HCl έχει στήλη g/l. Παίρνουμε από εκεί την τιμή για συγκέντρωση 15% - 166,4 g/l. Ο όγκος του νερού που απαιτείται για τη λήψη 15% HCl είναι 44,7/166,4≈270 ml. Θα πάρουμε 200 ml. Ως αποτέλεσμα, θεωρητικά, θα πάρω υδροχλωρικό οξύ 22%.
Στάδιο 3 - λήψη οξέος
Συνδέουμε τις δύο γωνίες ως εξής:
Και ολόκληρη η δομή θα μοιάζει με αυτό:
Το αντίστοιχο οξύ θα συμπυκνωθεί σε ένα δοχείο με την ένδειξη HCl· ο όγκος του νερού σε αυτό είναι 200 ml. Σημειώστε επίσης την τρέχουσα στάθμη υγρού σε αυτό το δοχείο.
Αφαιρούμε τις γωνίες και ρίχνουμε την υπολογιζόμενη ποσότητα αλατιού στη φιάλη μέσα από ένα χωνί.
Το διάλυμα γίνεται κίτρινο.
Για να αρχίσει να απελευθερώνεται το υδροχλωρικό οξύ, πρέπει να ενεργοποιήσετε τον καυστήρα. Αλλά πρώτα, στερεώνουμε σφιχτά τις γωνίες στη φιάλη και στο δοχείο υποδοχής.
Όταν το οξύ συμπυκνώνεται στο νερό, σχηματίζονται «κάθετα κύματα». Επίσης, το διάλυμα θερμαίνεται και πρέπει να ψυχθεί. Για παράδειγμα, μπορείτε να τοποθετήσετε ένα άλλο σκάφος με πάγο παρακάτω.
Η αντίδραση προχωρά σχετικά γρήγορα - 20 λεπτά, μετά την οποία μπορείτε να απενεργοποιήσετε τη θερμότητα. Αφήστε τους τελευταίους ατμούς του υδροχλωρικού οξέος να διαλυθούν στο νερό και στη συνέχεια σφραγίστε το δοχείο ερμητικά. Όταν η φιάλη κρυώσει, αραιώστε το υπόλοιπο διάλυμα με νερό (περίπου ένα προς ένα) και χύστε το στο υπόνομο.
Συμπέρασμα
Με το σημάδι στο δοχείο προσδιορίζουμε πόσο υγρό έχει προστεθεί. Για μένα είναι ⅙, δηλαδή 17%. Αυτή είναι η συγκέντρωση του υδροχλωρικού μας οξέος. Ας το συγκρίνουμε με αυτό που προκύπτει στη θεωρία.
17%/22%*100%=77% - απόδοση αντίδρασης.
Είναι σημαντικό να σημειωθεί ότι δεν υπάρχει έξοδος ίση με 1, υπάρχουν πάντα απώλειες. Στην περίπτωσή μου, πρόκειται για έναν ανεπαρκώς εξατμισμένο ηλεκτρολύτη. Ιδανικά, η συγκέντρωση του θειικού οξέος θα πρέπει να είναι 90-95%.
Ας ελέγξουμε το οξύ που προκύπτει για αλληλεπίδραση με μέταλλο.
Παρατηρούμε την ταχεία εξέλιξη του υδρογόνου. Αυτό σημαίνει ότι το οξύ είναι κατάλληλο για περαιτέρω πειράματα.
Παραλλαγές
Μπορείτε να χρησιμοποιήσετε ένα καθαρό γυάλινο μπουκάλι μπύρας ή σόδας ως φιάλη, αλλά με την προϋπόθεση ότι η θέρμανση είναι όσο το δυνατόν πιο ομαλή. Αντί για γωνίες PVC, μπορείτε να πάρετε σωλήνες πολυπροπυλενίου και γωνίες μικρότερης διαμέτρου (κατάλληλες για τη φιάλη σας).
Για άλλη μια φορά σας προτρέπω να ακολουθήσετε τα μέτρα ασφαλείας. Καλές εμπειρίες σε όλους!
Παρόμοια master classes
Ιδιαίτερα ενδιαφέρον
Σχόλια (19)