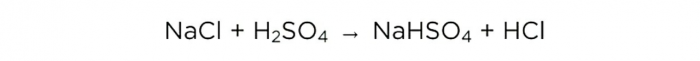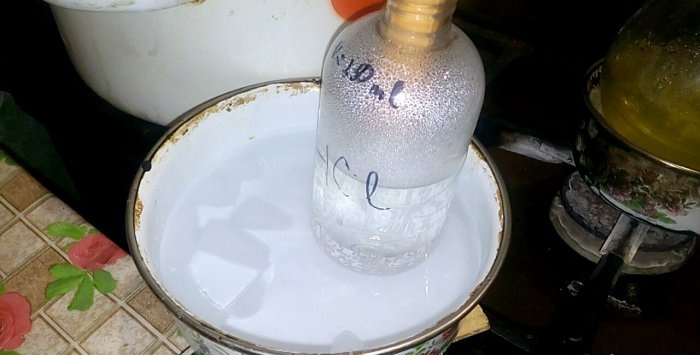Hacer ácido clorhídrico en casa.
Los alquimistas que produjeron ácido clorhídrico por primera vez en el siglo XV lo llamaron "spiritus salis", "espíritu de sal". En aquella época, este ácido tenía propiedades mágicas: corroía el papel, disolvía metales y envenenaba a las personas. Estas propiedades se conservan hasta el día de hoy, pero ahora este ácido ha sido suficientemente estudiado y no hay magia aquí.
El ácido clorhídrico (HCl) es un ácido monobásico fuerte, en su forma pura es un líquido transparente. En su concentración máxima del 38% “humea” en el aire. Recibiremos ácido con una concentración de la mitad.
Entonces empecemos.
Precauciones de seguridad
¡Tenga cuidado al trabajar con sustancias tóxicas!
Todos los experimentos deben realizarse en una habitación bien ventilada o bajo una campana, asegúrese de usar gafas de seguridad (se pueden comprar en ferretería) y guantes (si no puede encontrar guantes especiales para químicos, los adecuados son de buena calidad). para lavar platos).
Debe haber bicarbonato de sodio en el lugar del experimento para neutralizar el ácido en una situación imprevista (esto liberará dióxido de carbono y agua).
Está estrictamente prohibido realizar experimentos en recipientes metálicos.
Necesitará
Para realizar el experimento necesitaremos:
- Electrolito ácido para baterías (vendido en una tienda de automóviles);
- Agua destilada (ibid);
- Sal de mesa (disponible en cualquier cocina);
- Bicarbonato de sodio (ver precauciones de seguridad).
De los platos que necesitas:
- matraz de vidrio;
- Un recipiente con arena donde puedas colocar el matraz;
- Varios vasos desechables de 200 ml;
Si tiene un matraz resistente al calor, puede calentarlo bajo la llama de un quemador. Pero sigo recomendando usar arena, en cuyo caso absorberá el ácido.
También necesitarás un par de ángulos de plomería de 50 mm de diámetro y un quemador (en mi caso de alcohol, pero recomiendo usar uno de gas).
Etapa 1 - evaporación
El electrolito de las baterías es 36% de ácido sulfúrico (H2SO4). Primero necesitamos aumentar su concentración.
Echar 200 ml en el vaso, es decir casi hasta el borde, y verter en el matraz un poco más de la mitad del vaso. Haz una marca con un marcador y agrega el resto.
Coloqué un reflector de aluminio alrededor del matraz para un calentamiento más eficiente, pero luego lo quité porque comenzó a derretirse.
Ahora ponga el matraz al fuego y evapore hasta el nivel de la marca previamente marcada, incluso un poco más abajo.
Al mismo tiempo, colocamos una gasa doblada varias veces en la esquina y la aseguramos con una banda elástica. Prepare una solución de soda insaturada y sumerja el extremo de la esquina con una gasa.
Cuando el electrolito comienza a hervir, colocamos una esquina en el matraz, se asienta firmemente sobre él. Dirigimos el extremo de la gasa hacia la ventana abierta.
Esto es necesario si de repente el ácido sulfúrico comienza a evaporarse junto con el agua. Si no sobrecalientas demasiado el matraz, esto no sucederá.
Quemador en acción:
Mi quemador tiene una potencia relativamente baja, por lo que la evaporación tardó aproximadamente una hora.Un quemador de gas o una estufa eléctrica aceleraría significativamente este proceso.
Después de completar la primera etapa, debe quedar en el matraz un poco menos de la mitad de la solución, es decir, un ácido con una concentración de aproximadamente el 75%. No te olvides de la precisión.
Déjelo enfriar a temperatura ambiente.
Etapa 2 - cálculos
Ahora que tenemos ácido sulfúrico concentrado, podemos realizar la reacción básica, queda así:
Pero primero hagamos algunos cálculos y al final los compararemos con lo que sucedió en la práctica.
Así, inicialmente teníamos 200 ml de electrolito con una densidad de 1,27 g/cm³. Si observamos la tabla de densidades del ácido sulfúrico, vemos que esta densidad corresponde a una concentración del 36%. Calculemos el volumen de ácido:
200ml*36%=72ml - V(H2SO4)
Después de que evaporamos la solución, su concentración y, por lo tanto, su densidad aumentaron. Observamos la misma tabla y vemos que una concentración del 75% corresponde a una densidad de 1,67 g/cm³.
Conociendo la densidad de corriente (p) y el volumen (V) del ácido, encontramos la masa:
m=p*V;
m(H2SO4)=1,67g/cm³ * 72ml=120g;
m(H2SO4)=1,67g/cm³ * 72ml=120g;
Ahora recordamos de la química escolar:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
donde M es la masa molar de la sustancia.
donde M es la masa molar de la sustancia.
Las masas molares de H2SO4, NaCl y HCl son 98, 58,5 y 36,5 g/mol, respectivamente. Ahora podemos saber cuánta sal de mesa se necesita y cuánto HCl obtendremos.
Es decir, necesitamos 72 g de NaCl, es decir, 34 ml, tomemos un exceso: un cuarto de vaso.
Genial, y el HCl, en teoría, saldrá a 44,7 g.
La tabla de densidad de HCl tiene una columna de g/l. De ahí tomamos el valor para una concentración del 15% - 166,4 g/l. El volumen de agua necesario para obtener HCl al 15% es 44,7/166,4≈270ml. Tomaremos 200ml. Como resultado, en teoría obtendré un 22% de ácido clorhídrico.
Etapa 3: obtención de ácido
Conectamos las dos esquinas de la siguiente manera:
Y toda la estructura se verá así:
El ácido correspondiente se condensará en un recipiente rotulado HCl; el volumen de agua que contiene es de 200 ml. Marque también el nivel de líquido actual en este recipiente.
Quitamos las esquinas y vertemos la cantidad calculada de sal en el matraz a través de un embudo.
La solución se vuelve amarilla.
Para que el ácido clorhídrico comience a liberarse, es necesario encender el quemador. Pero primero, unimos firmemente las esquinas al matraz y al recipiente receptor.
Cuando el ácido se condensa en agua, se forman "ondas verticales". Además, la solución se calienta y debe enfriarse. Por ejemplo, puedes colocar otro recipiente con hielo debajo.
La reacción avanza relativamente rápido: 20 minutos, después de los cuales se puede apagar el fuego. Deje que los últimos vapores de ácido clorhídrico se disuelvan en el agua y luego cierre herméticamente el recipiente. Cuando el matraz se haya enfriado, diluya la solución restante con agua (aproximadamente uno a uno) y viértala en la alcantarilla.
Línea de fondo
Por la marca en el recipiente determinamos cuánto líquido se ha agregado. Para mí es ⅙, es decir, 17%. Esta es la concentración de nuestro ácido clorhídrico. Comparémoslo con el obtenido en teoría.
17%/22%*100%=77% - rendimiento de la reacción.
Es importante señalar que no hay producción igual a 1, siempre hay pérdidas. En mi caso, se trata de un electrolito insuficientemente evaporado. Lo ideal es que la concentración de ácido sulfúrico sea del 90-95%.
Comprobemos la interacción del ácido resultante con el metal.
Observamos una rápida evolución del hidrógeno. Esto significa que el ácido es adecuado para futuros experimentos.
Variaciones
Puedes utilizar una botella de vidrio limpia de cerveza o refresco como matraz, pero siempre que el calentamiento sea lo más suave posible. En lugar de esquinas de PVC, puede utilizar tubos de polipropileno y esquinas de menor diámetro (adecuadas para su matraz).
Una vez más les insto a seguir las precauciones de seguridad. ¡Felices experiencias a todos!
Clases magistrales similares
Particularmente interesante
Comentarios (19)