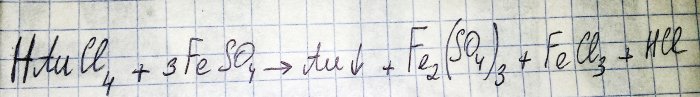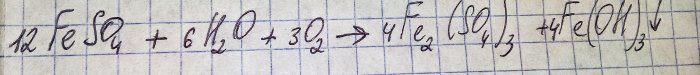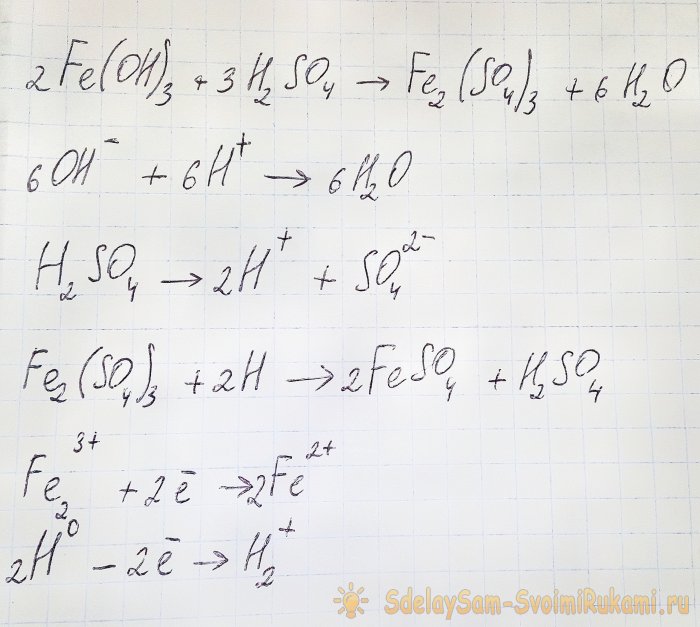Nopea tapa saada rautasulfaattia lannoitteesta
Toiseksi viimeinen vaihe tiellä jalometallin saamiseksi radiokomponenteista on jälkimmäisen pelkistys vastaavasta kloridista. Rauta(II)sulfaatti on erinomainen näihin tarkoituksiin. Harkitse tämän reaktion yhtälöä:
HAuCl4 - vetytetraklooriauraatti (III) - yhdiste, joka muodostuu, kun kultaa liukenee Aqua Regiaan. Emme mene syvemmälle tähän prosessiin nyt, koska se ansaitsee erillisen artikkelin.
Joten sulfaatti (jäljempänä tarkoitetaan rauta(II)sulfaattia) on yksi halvoista ja helposti saatavilla olevista pelkistävistä aineista. Kaupoista se löytyy nimellä "rautasulfaatti", se on lannoite. Mutta tämä ei ole puhdas aine, sulfaatin osuus siinä on noin 50%, loput ovat epäpuhtauksia. Ja ennen kuin voimme palauttaa kullan, meidän on puhdistettava sulfaattimme.
Tulen tarvitsemaan
Tätä varten tarvitset:
- Rautasulfaatti (myydään kaupoissa kuten "kaikki puutarhaan"; ostin kilon, jotta minulla riittää pääni);
- Rikkihappoliuos, joka tunnetaan myös akkujen happoelektrolyyttinä (autoliikkeissä);
- Alkoholi, käytin 95%;
- Kemialliset tai kertakäyttöastiat (kupit, sekoituslusikat).
Saamme rautasulfaattia lannoitteista
Käytän liuoksen valmistamiseen lasipurkkia. Sisällä on 500 ml kuumaa vettä, ehkä hieman vähemmän.
Mittaa nyt noin puoli lasillista lannoitetta:
Kuten näette, aine on väriltään kellanruskea, tällaista likaista "sulfaattia" voidaan käyttää vain aiottuun tarkoitukseen - kasvillisuuden ruiskuttamiseen. Meillä on muita tavoitteita.
Kaada se purkkiin:
Liuos muuttui epämiellyttäväksi ruskeaksi. Väritys johtui lannoitteen reaktiosta veden kanssa:
Sulfaatissa oleva rauta hapettuu kolmiarvoiseksi ja rauta(III)hydroksidi saostuu, mikä on itse asiassa syy sen väriin.
Jotta saatavista yhdisteistä saataisiin kiinnostavaa sulfaattia, liuos on hapotettava rikkihapolla. Lisää pienissä erissä, kunnes liuos vaalenee.
Tässä tapauksessa esiintyy seuraavia reaktioita:
Hydroksidi reagoi hapon kanssa muodostaen rauta(III)sulfaattia (ioninvaihtoreaktio). Se vuorostaan reagoi atomivedyn kanssa, joka muodostuu rikkihapon hajoamisen aikana. Viimeinen reaktio on redox.
Nyt liuos sisältää täsmälleen tarvitsemamme sulfaatin, mutta itse liuos on edelleen samea. Anna sen istua ja suodattaa, käytin kemiallista suodatinta.
Purkin pohjalle jäi liukenemattomia epäpuhtauksia:
Huuhtelemme sen ja kaadamme suodatetun liuoksen siihen. Se on paljon kevyempi ja puhtaampi kuin alkuperäinen.
Etyylialkoholi syrjäyttää kaksiemäksisten happojen suolat liuoksistaan. Käytämme tätä ominaisuutta kiinteän sulfaatin saamiseksi. Lisäämme liuokseen alkoholia, kaadoin 200 ml, joka vastaa tilavuudeltaan hieman yli puolta alkuperäisestä lannoitteen tilavuudesta.
Pohjalle ilmestyi sulfaattimme kiteitä.
Jätin liuoksen kahdeksi päiväksi, jotta kaikella sulfaatilla oli aikaa saostua.
Voit aluksi lisätä enemmän alkoholia nopeuttaaksesi tätä prosessia.
Valuta neste pohjaa napauttamalla ja kevyesti lämmittämällä, erota sulfaatti purkista ja kaada se talouspaperin päälle kuivumaan.
Muutaman tunnin kuluttua kaada sulfaatti lasipurkkiin, merkitse aine, ja tässä muodossa sitä voidaan säilyttää pitkään.
Koska kiteisiä hydraatteja saostui, aineen kaava on kuten kuvassa. Mutta tämä ei estä meitä käyttämästä sitä omiin tarkoituksiin, liuottamalla sitä veteen joka tapauksessa.
Johtopäätös
Turvallisuustoimenpiteet ja happojen käsittelyä koskevien sääntöjen noudattaminen ovat itsestäänselvyyksiä. Emme saa missään tapauksessa unohtaa niitä.
Puhtaita aineita kaikille!
Samanlaisia mestarikursseja
Erityisen mielenkiintoista
Kommentit (1)