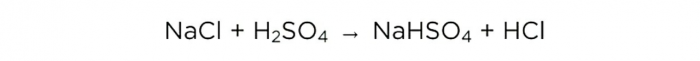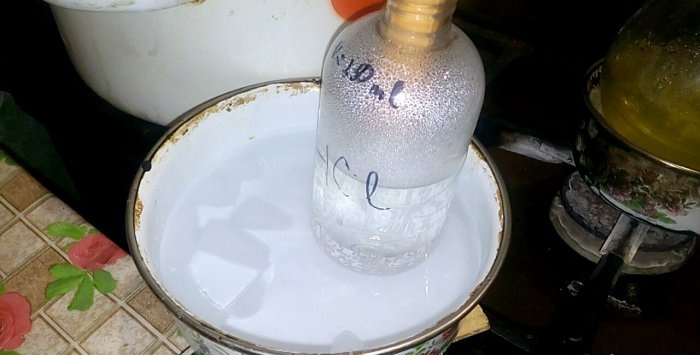Fabriquer de l'acide chlorhydrique à la maison
Les alchimistes qui ont produit pour la première fois de l’acide chlorhydrique au XVe siècle l’appelaient « spiritus salis », « esprit du sel ». À cette époque, cet acide avait des propriétés magiques : il corrodait le papier, dissolvait les métaux et empoisonnait les gens. Ces propriétés lui restent à ce jour, mais maintenant cet acide a été suffisamment étudié et il n'y a pas de magie ici.
L'acide chlorhydrique (HCl) est un acide monobasique fort, sous sa forme pure c'est un liquide transparent. À sa concentration maximale de 38 %, il « fume » dans l’air. Nous recevrons de l'acide avec une concentration de moitié.
Alors, commençons.
Précautions de sécurité
Soyez prudent lorsque vous travaillez avec des substances toxiques !
Toutes les expériences doivent être réalisées dans une pièce bien ventilée ou sous une hotte. Assurez-vous de porter des lunettes de sécurité (peuvent être achetées en quincaillerie) et des gants (si vous ne trouvez pas de gants chimiques spéciaux, ceux de bonne qualité conviennent pour faire la vaisselle).
Le bicarbonate de soude doit être présent sur le site de l'expérience afin de neutraliser l'acide dans une situation imprévue (cela libérera du dioxyde de carbone et de l'eau).
Il est strictement interdit de réaliser des expériences dans des récipients métalliques.
Aura besoin
Pour réaliser l’expérience, nous aurons besoin de :
- Électrolyte acide pour batteries (vendu dans un magasin automobile) ;
- Eau distillée (ibid.);
- Sel de table (disponible dans n'importe quelle cuisine) ;
- Bicarbonate de soude (voir les précautions de sécurité).
Parmi les plats dont vous avez besoin :
- Flacon en verre ;
- Un récipient avec du sable où vous pourrez placer le flacon ;
- Plusieurs gobelets jetables 200 ml ;
Si vous disposez d'un flacon résistant à la chaleur, vous pouvez le chauffer sous la flamme nue d'un brûleur. Mais je recommande quand même d’utiliser du sable, auquel cas il absorbera l’acide.
Vous aurez également besoin d'une paire d'angles de plomberie d'un diamètre de 50 mm et d'un brûleur (dans mon cas, de l'alcool, mais je recommande d'en utiliser un à gaz).
Étape 1 - évaporation
L'électrolyte des batteries est composé à 36 % d'acide sulfurique (H2SO4). Nous devons d’abord augmenter sa concentration.
Versez 200 ml dans le verre, c'est-à-dire presque jusqu'au bord, et versez un peu plus de la moitié du verre dans le flacon. Faites une marque avec un marqueur et ajoutez le reste.
J'ai placé un réflecteur en aluminium autour du ballon pour un chauffage plus efficace, mais je l'ai ensuite retiré car il commençait à fondre.
Mettez maintenant le ballon sur le brûleur et évaporez jusqu'au niveau du repère précédemment fixé, voire un peu plus bas.
En même temps, on met de la gaze pliée plusieurs fois sur le coin et on la fixe avec un élastique. Préparez une solution de soude insaturée et plongez-y l'extrémité du coin avec de la gaze.
Lorsque l'électrolyte commence à bouillir, on met un coin sur le ballon, il repose bien dessus. Nous dirigeons l'extrémité de la gaze vers la fenêtre ouverte.
Cela est nécessaire si soudainement l'acide sulfurique lui-même commence à s'évaporer avec l'eau. Si vous ne surchauffez pas trop le ballon, cela n'arrivera pas.
Brûleur en action :
Mon brûleur a une puissance relativement faible, donc l'évaporation a pris environ une heure.Un brûleur à gaz ou une cuisinière électrique accélérerait considérablement ce processus.
Après avoir terminé la première étape, il doit rester dans le ballon un peu moins de la moitié de la solution, c'est-à-dire un acide avec une concentration d'environ 75 %. N'oubliez pas la précision.
Laissez-le refroidir à température ambiante.
Étape 2 - calculs
Maintenant que nous avons de l’acide sulfurique concentré, nous pouvons effectuer la réaction basique, elle ressemble à ceci :
Mais d'abord, faisons quelques calculs, et à la fin nous les comparerons avec ce qui s'est passé dans la pratique.
Ainsi, au départ nous avions 200 ml d’électrolyte d’une densité de 1,27 g/cm³. En regardant le tableau des densités de l'acide sulfurique, on voit que cette densité correspond à une concentration de 36%. Calculons le volume d'acide :
200 ml*36 % = 72 ml - V(H2SO4)
Après avoir évaporé la solution, sa concentration, et donc sa densité, a augmenté. On regarde le même tableau et on voit qu'une concentration de 75% correspond à une densité de 1,67 g/cm³.
Connaissant la densité de courant (p) et le volume (V) de l'acide, on connaît la masse :
m=p*V;
m(H2SO4)=1,67 g/cm³ * 72 ml=120 g ;
m(H2SO4)=1,67 g/cm³ * 72 ml=120 g ;
Maintenant, nous nous souvenons de la chimie scolaire :
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
où M est la masse molaire de la substance.
où M est la masse molaire de la substance.
Les masses molaires de H2SO4, NaCl et HCl sont respectivement de 98, 58,5 et 36,5 g/mol. Nous pouvons maintenant savoir quelle quantité de sel de table est nécessaire et quelle quantité de HCl nous obtiendrons.
A savoir, nous avons besoin de 72 g de NaCl, soit 34 ml, prenons-en en excès - un quart de verre.
Génial, et HCl en théorie reviendra à 44,7 g.
Le tableau de densité HCl comporte une colonne g/l. On en déduit la valeur pour une concentration de 15% - 166,4 g/l. Le volume d'eau nécessaire pour obtenir 15 % de HCl est de 44,7/166,4≈270 ml. Nous prendrons 200 ml. Du coup, en théorie, j'obtiendrai 22% d'acide chlorhydrique.
Étape 3 - obtention de l'acide
Nous connectons les deux coins comme suit :
Et toute la structure ressemblera à ceci :
L'acide correspondant se condensera dans un récipient étiqueté HCl ; le volume d'eau qu'il contient est de 200 ml. Marquez également le niveau de liquide actuel sur ce récipient.
Nous retirons les coins et versons la quantité calculée de sel dans le flacon à travers un entonnoir.
La solution devient jaune.
Pour que l'acide chlorhydrique commence à se libérer, vous devez allumer le brûleur. Mais d'abord, nous attachons étroitement les coins au flacon et au récipient récepteur.
Lorsque l’acide se condense dans l’eau, des « ondes verticales » se forment. De plus, la solution chauffe et doit être refroidie. Par exemple, vous pouvez placer un autre récipient avec de la glace en dessous.
La réaction se déroule relativement rapidement - 20 minutes, après quoi vous pouvez éteindre le feu. Laissez les dernières vapeurs d'acide chlorhydrique se dissoudre dans l'eau, puis fermez hermétiquement le récipient. Une fois le ballon refroidi, diluez la solution restante avec de l'eau (environ un pour un) et versez-la à l'égout.
Conclusion
Par la marque sur le récipient, nous déterminons la quantité de liquide ajoutée. Pour moi, c'est ⅙, soit 17 %. C'est la concentration de notre acide chlorhydrique. Comparons-le avec celui obtenu en théorie.
17%/22%*100%=77% - rendement de la réaction.
Il est important de noter qu’il n’existe pas de rendement égal à 1, il y a toujours des pertes. Dans mon cas, il s'agit d'un électrolyte insuffisamment évaporé. Idéalement, la concentration d'acide sulfurique devrait être de 90 à 95 %.
Vérifions l'acide résultant pour l'interaction avec le métal.
Nous observons une évolution rapide de l’hydrogène. Cela signifie que l’acide convient à d’autres expériences.
Variantes
Vous pouvez utiliser une bouteille de bière ou de soda en verre propre comme flacon, mais à condition que le chauffage soit le plus doux possible. Au lieu de coins en PVC, vous pouvez prendre des tuyaux en polypropylène et des coins de plus petit diamètre (adaptés à votre flacon).
Encore une fois, je vous invite à respecter les précautions de sécurité. Bonnes expériences à tous !
Classes de maître similaires

Fabriquer de l'acide chlorhydrique à la maison

Obtention d'ADN à la maison

Une méthode accélérée pour éliminer la rouille avec une solution d'acide citrique

Fabriquer du phosphore à la maison

Un moyen peu coûteux de nettoyer les bougies d’allumage et de prolonger leur durée de vie

Comment nettoyer une presse française des dépôts de thé
Particulièrement intéressant
Commentaires (19)