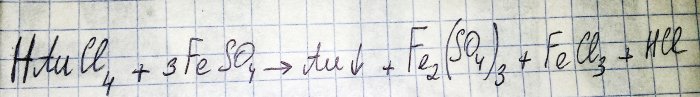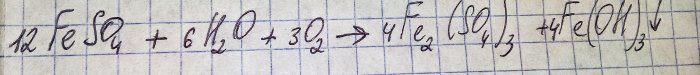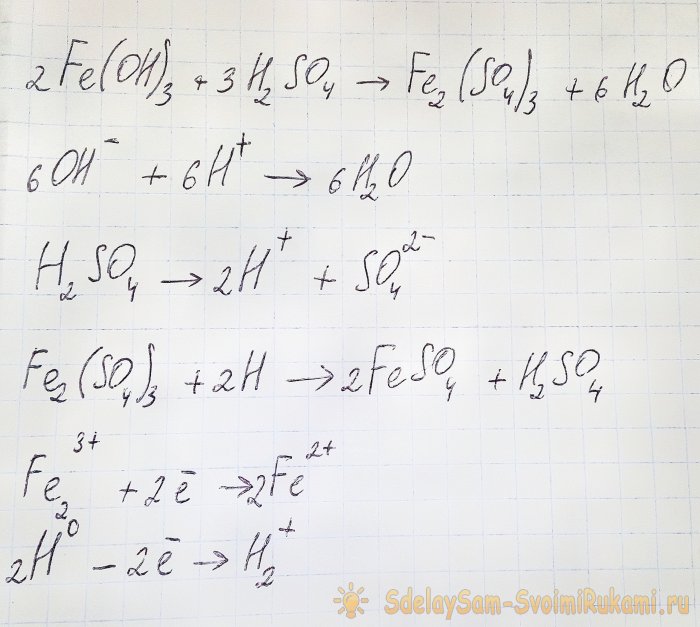Un moyen rapide d'obtenir du sulfate ferreux à partir d'engrais
L'avant-dernière étape vers l'obtention d'un métal noble à partir de composants radio est la réduction de ce dernier à partir du chlorure correspondant. Le sulfate de fer (II) est excellent à ces fins. Considérons l'équation de cette réaction :
HAuCl4 - tétrachloroaurate d'hydrogène (III) - un composé qui se forme lorsque l'or est dissous dans l'eau régale. Nous n’approfondirons pas ce processus pour l’instant, car il mérite un article séparé.
Ainsi, le sulfate (on entend ci-après le sulfate de fer (II)) est l’un des agents réducteurs bon marché et facilement disponibles. En magasin on le trouve sous le nom de « sulfate de fer », c'est un engrais. Mais ce n'est pas une substance pure, la proportion de sulfate est d'environ 50%, le reste est constitué d'impuretés. Et avant de pouvoir restaurer l’or, nous devons purifier notre sulfate.
Aura besoin
Pour cela vous aurez besoin de :
- Sulfate de fer (vendu en magasin comme « tout pour le jardin » ; j'en ai acheté un kilo pour en avoir assez pour ma tête) ;
- Solution d'acide sulfurique, également appelée électrolyte acide pour batteries (chez les concessionnaires automobiles) ;
- De l'alcool, j'en ai consommé 95 % ;
- Vaisselle chimique ou jetable (tasses, cuillères à mélanger).
Nous obtenons du sulfate de fer à partir d'engrais
J'utilise un bocal en verre pour préparer la solution. A l'intérieur il y a 500 ml d'eau chaude, peut-être un peu moins.
Mesurez maintenant environ un demi-verre d’engrais :
Comme vous pouvez le constater, la substance est de couleur jaune-brun; un tel «sulfate» sale ne peut être utilisé que pour l'usage auquel il est destiné - pour pulvériser la végétation. Nous avons d'autres objectifs.
Versez-le dans le pot :
La solution a pris une couleur brune désagréable. La coloration est due à la réaction de l'engrais avec l'eau :
Le fer contenu dans le sulfate est oxydé en trivalent et l'hydroxyde de fer (III) précipite, ce qui est en fait la raison de sa couleur.
Afin d'obtenir le sulfate qui nous intéresse à partir des composés résultants, il est nécessaire d'acidifier la solution avec de l'acide sulfurique. Ajouter par petites portions jusqu'à ce que la solution s'éclaircisse.
Dans ce cas, les réactions suivantes se produisent :
L'hydroxyde réagit avec l'acide pour former du sulfate de fer (III) (réaction d'échange d'ions). Il réagit à son tour avec l’hydrogène atomique, formé lors de la dissociation de l’acide sulfurique. La dernière réaction est redox.
La solution contient désormais exactement le sulfate dont nous avons besoin, mais la solution elle-même est encore trouble. Laissez reposer et filtrez-le, j'ai utilisé un filtre chimique.
Des impuretés insolubles sont restées au fond du pot :
Nous le rinçons et y versons la solution filtrée. Il est beaucoup plus léger et plus propre que l'original.
L'alcool éthylique déplace les sels d'acides dibasiques de leurs solutions. Nous utiliserons cette propriété pour obtenir du sulfate solide. Nous ajoutons de l'alcool à la solution, j'en ai versé 200 ml, ce qui équivaut en volume à un peu plus de la moitié du volume initial d'engrais.
Des cristaux de notre sulfate sont apparus au fond.
J'ai laissé la solution deux jours pour que tout le sulfate ait le temps de précipiter.
Vous pouvez d’abord ajouter plus d’alcool pour accélérer ce processus.
Égoutter le liquide en tapotant le fond et en chauffant doucement, séparer le sulfate du pot et le verser sur une serviette en papier pour le faire sécher.
Après quelques heures, versez le sulfate dans un bocal en verre, étiquetez la substance et, sous cette forme, elle peut être conservée longtemps.
Depuis que les hydrates cristallins ont précipité, la formule de la substance est celle de l'image. Mais cela ne nous empêche pas de l'utiliser à nos propres fins, en le dissolvant de toute façon dans l'eau.
Conclusion
Les précautions de sécurité et le respect des règles de manipulation des acides vont de soi. Il ne faut en aucun cas les oublier.
Des substances propres à tous !
Classes de maître similaires
Particulièrement intéressant
Commentaires (1)