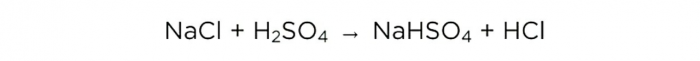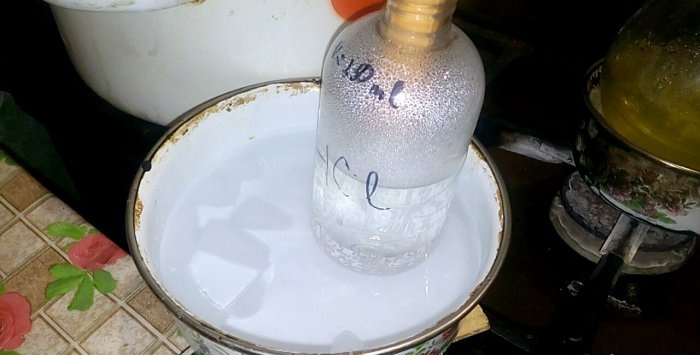Izrada klorovodične kiseline kod kuće
Alkemičari koji su prvi proizveli solnu kiselinu u 15. stoljeću nazvali su je "spiritus salis", "duh iz soli". U to vrijeme ta je kiselina imala čarobna svojstva: nagrizala je papir, otapala metale i trovala ljude. Ta su svojstva ostala s njim do danas, ali sada je ova kiselina dovoljno proučena i tu nema nikakve magije.
Klorovodična kiselina (HCl) je jaka jednobazna kiselina, u svom čistom obliku je prozirna tekućina. U maksimalnoj koncentraciji od 38% "dimi" u zraku. Dobit ćemo kiselinu upola manje koncentracije.
Pa krenimo.
Sigurnosne mjere opreza
Budite oprezni pri radu s otrovnim tvarima!
Svi pokusi moraju se provoditi u dobro prozračenoj prostoriji ili pod poklopcem. Obavezno nosite zaštitne naočale (mogu se kupiti u trgovini hardverom) i rukavice (ako ne možete pronaći posebne kemijske rukavice, prikladne su one dobre kvalitete za pranje suđa).
Na mjestu pokusa mora biti prisutna soda bikarbona kako bi se u nepredviđenoj situaciji neutralizirala kiselina (pritom će se osloboditi ugljični dioksid i voda).
Strogo je zabranjeno provoditi pokuse u metalnim posudama.
Trebat će
Za provođenje eksperimenta trebat će nam:
- Kiselinski elektrolit za baterije (prodaje se u trgovini automobila);
- Destilirana voda (ibid);
- Kuhinjska sol (dostupna u bilo kojoj kuhinji);
- Soda bikarbona (vidi sigurnosne mjere).
Od posuđa vam je potrebno:
- Staklena tikvica;
- Posuda s pijeskom u koju možete staviti tikvicu;
- Nekoliko čaša za jednokratnu upotrebu 200 ml;
Ako imate tikvicu otpornu na toplinu, možete je zagrijati pod otvorenim plamenom plamenika. Ali ipak preporučam korištenje pijeska, u kojem će slučaju apsorbirati kiselinu.
Trebat će vam i par vodovodnih uglova promjera 50 mm i plamenik (u mom slučaju alkohol, ali preporučujem korištenje plina).
Faza 1 - isparavanje
Elektrolit za baterije je 36% sumporna kiselina (H2SO4). Prvo moramo povećati njegovu koncentraciju.
U čašu ulijte 200 ml, odnosno skoro do ruba, au tikvicu ulijte malo više od pola čaše. Označite markerom i dodajte ostatak.
Stavio sam reflektor od folije oko tikvice radi učinkovitijeg zagrijavanja, ali sam ga kasnije uklonio jer se počeo topiti.
Sada stavite tikvicu na plamenik i isparite do razine prethodno postavljene oznake, čak i malo niže.
Istovremeno na kut stavimo nekoliko puta presavijenu gazu i pričvrstimo je gumicom. Pripremite nezasićenu otopinu sode i umočite u nju kraj kuta s gazom.
Kad elektrolit počne kuhati, stavimo kut na tikvicu, čvrsto sjedi na njemu. Usmjeravamo kraj gaze u otvoreni prozor.
To je neophodno ako iznenada sama sumporna kiselina počne isparavati zajedno s vodom. Ako tikvicu ne pregrijete previše, to se neće dogoditi.
Plamenik u akciji:
Moj plamenik je relativno niske snage, tako da je isparavanje trajalo oko sat vremena.Plinski plamenik ili električni štednjak značajno bi ubrzali ovaj proces.
Nakon završetka prve faze u tikvici bi trebalo ostati nešto manje od polovice otopine, odnosno kiseline koncentracije oko 75%. Ne zaboravite na točnost.
Neka se ohladi na sobnoj temperaturi.
Faza 2 - izračuni
Sada kada imamo koncentriranu sumpornu kiselinu, možemo izvesti bazičnu reakciju, koja izgleda ovako:
Ali prvo napravimo neke izračune, a na kraju ćemo ih usporediti s onim što se dogodilo u praksi.
Dakle, u početku smo imali 200 ml elektrolita gustoće 1,27 g/cm³. Gledajući tablicu gustoće sumporne kiseline, vidimo da ta gustoća odgovara koncentraciji od 36%. Izračunajmo volumen kiseline:
200ml*36%=72ml - V(H2SO4)
Nakon što smo otopinu isparili, njezina koncentracija, a time i gustoća, se povećala. Pogledamo istu tablicu i vidimo da koncentracija od 75% odgovara gustoći od 1,67 g/cm³.
Poznavajući gustoću struje (p) i volumen (V) kiseline, saznajemo masu:
m=p*V;
m(H2SO4)=1,67g/cm³ * 72ml=120g;
m(H2SO4)=1,67g/cm³ * 72ml=120g;
Sada se sjećamo iz školske kemije:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
gdje je M molarna masa tvari.
gdje je M molarna masa tvari.
Molarne mase H2SO4, NaCl i HCl su 98, 58,5 odnosno 36,5 g/mol. Sada možemo saznati koliko je kuhinjske soli potrebno i koliko ćemo dobiti HCl.
Naime, potrebno nam je 72 g NaCl, to je 34 ml, uzmimo više - četvrtina čaše.
Super, a HCl će u teoriji izaći na 44,7 g.
Tablica gustoće HCl ima stupac g/l. Odatle uzimamo vrijednost za koncentraciju od 15% - 166,4 g/l. Volumen vode potreban za dobivanje 15% HCl je 44,7/166,4≈270ml. Uzet ćemo 200 ml. Kao rezultat toga, u teoriji ću dobiti 22% klorovodične kiseline.
Faza 3 - dobivanje kiseline
Povezujemo dva ugla na sljedeći način:
I cijela struktura će izgledati ovako:
Odgovarajuća kiselina će se kondenzirati u posudu označenu s HCl; volumen vode u njoj je 200 ml. Također označite trenutnu razinu tekućine na ovoj posudi.
Skinemo kutove i kroz lijevak ulijemo izračunatu količinu soli u tikvicu.
Otopina postaje žuta.
Da bi klorovodična kiselina počela ispuštati potrebno je upaliti plamenik. Ali prvo, čvrsto pričvrstimo uglove na tikvicu i prihvatnu posudu.
Kada se kiselina kondenzira u vodi, nastaju "vertikalni valovi". Također, otopina se zagrijava i mora se ohladiti. Na primjer, ispod možete staviti drugu posudu s ledom.
Reakcija se odvija relativno brzo - 20 minuta, nakon čega možete isključiti vatru. Pustite da se posljednje pare klorovodične kiseline otope u vodi, a zatim hermetički zatvorite posudu. Kada se tikvica ohladi, preostalu otopinu razrijedite vodom (otprilike jedan prema jedan) i izlijte u kanalizaciju.
Poanta
Po oznaci na posudi utvrđujemo koliko je tekućine dodano. Kod mene je ⅙, odnosno 17%. Ovo je koncentracija naše klorovodične kiseline. Usporedimo ga s onim dobivenim u teoriji.
17%/22%*100%=77% - reakcijski prinos.
Važno je napomenuti da ne postoji izlaz jednak 1, uvijek postoje gubici. U mom slučaju radi se o nedovoljno isparenom elektrolitu. U idealnom slučaju, koncentracija sumporne kiseline trebala bi biti 90-95%.
Provjerimo interakciju dobivene kiseline s metalom.
Promatramo brzu evoluciju vodika. To znači da je kiselina prikladna za daljnje pokuse.
Varijacije
Kao tikvicu možete koristiti čistu staklenu bocu od piva ili soda, ali pod uvjetom da je zagrijavanje što je moguće lakše. Umjesto PVC uglova, možete uzeti polipropilenske cijevi i uglove manjeg promjera (prikladne za vašu tikvicu).
Još jednom vas pozivam da se pridržavate mjera opreza. Sretna iskustva svima!
Slične majstorske tečajeve
Posebno zanimljivo
Komentari (19)