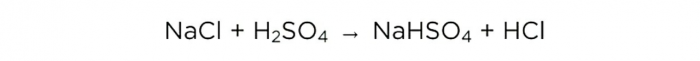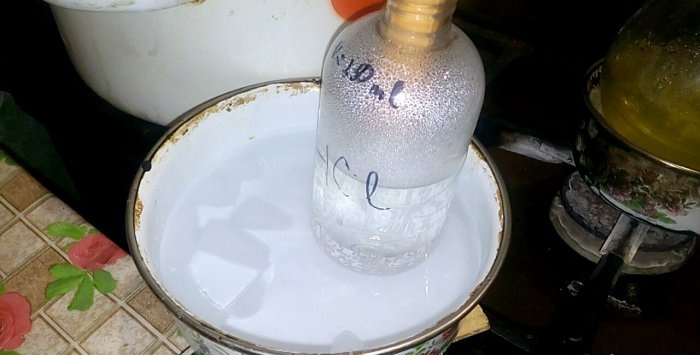Sósav készítése otthon
Az alkimisták, akik először állítottak elő sósavat a 15. században, „spiritus salisnak”, „sóból származó szellemnek” nevezték. Ez a sav akkoriban mágikus tulajdonságokkal bírt: korrodálta a papírt, feloldotta a fémeket, megmérgezte az embereket. Ezek a tulajdonságok a mai napig megmaradtak nála, de most ezt a savat kellőképpen tanulmányozták, és nincs itt semmi varázslat.
A sósav (HCl) erős egybázisú sav, tiszta formájában átlátszó folyadék. Maximális, 38%-os koncentrációjában „füstöl” a levegőben. Ennek fele koncentrációjú savat kapunk.
Tehát kezdjük.
Biztonsági intézkedések
Legyen óvatos, ha mérgező anyagokkal dolgozik!
Minden kísérletet jól szellőző helyiségben vagy csuklya alatt kell végezni.. Feltétlenül viseljen védőszemüveget (boltban vásárolható) és kesztyűt (ha nem talál speciális vegyszeres kesztyűt, jó minőségű a megfelelő mosogatáshoz).
A kísérlet helyén szódabikarbónának kell lennie, hogy előre nem látható helyzetben semlegesítse a sav (ez szén-dioxidot és vizet szabadít fel).
Szigorúan tilos fémtartályokban kísérleteket végezni.
Szükség lesz
A kísérlet elvégzéséhez szükségünk lesz:
- Savas elektrolit akkumulátorokhoz (autóboltban kapható);
- desztillált víz (uo.);
- asztali só (bármely konyhában kapható);
- Szódabikarbóna (lásd a biztonsági óvintézkedéseket).
A szükséges ételek közül:
- Üveg lombik;
- Egy edény homokkal, ahová elhelyezheti a lombikot;
- Több eldobható csésze 200 ml;
Ha van hőálló lombik, akkor azt egy égő nyílt lángja alatt melegítheti. De továbbra is javaslom a homokot, ilyenkor felszívja a savat.
Szükség lesz még egy 50 mm átmérőjű vízvezeték-szögre és egy égőre (esetemben alkoholra, de javaslom a gázt).
1. szakasz - párolgás
Az akkumulátorok elektrolitja 36%-os kénsav (H2SO4). Először is növelnünk kell a koncentrációját.
Öntsön 200 ml-t a pohárba, vagyis majdnem színültig, és öntsön valamivel több, mint a pohár felét a lombikba. Jelölje meg a jelölőt, és adja hozzá a többit.
Fólia reflektort helyeztem a lombik köré a hatékonyabb fűtés érdekében, de később eltávolítottam, mert olvadni kezdett.
Most helyezze a lombikot az égőre, és párolja el az előzőleg beállított jel szintjéig, még egy kicsit lejjebb.
Ugyanakkor a sarkára többször összehajtott gézt teszünk, és gumiszalaggal rögzítjük. Készítsen telítetlen szódaoldatot, és mártsa bele a sarok végét gézzel.
Amikor az elektrolit forrni kezd, sarkot teszünk a lombikra, szorosan ráül. A géz végét a nyitott ablakba irányítjuk.
Erre akkor van szükség, ha hirtelen maga a kénsav is elkezd párologni a vízzel együtt. Ha nem melegíti túl a lombikot, ez nem fog megtörténni.
Égő működés közben:
Az égőm viszonylag alacsony teljesítményű, így a párolgás körülbelül egy órát vett igénybe.Egy gázégő vagy elektromos tűzhely jelentősen felgyorsítaná ezt a folyamatot.
Az első szakasz befejezése után az oldatnak valamivel kevesebb, mint felének kell maradnia a lombikban, vagyis körülbelül 75% -os koncentrációjú savnak. Ne feledkezzünk meg a pontosságról.
Hagyjuk szobahőmérsékletűre hűlni.
2. szakasz - számítások
Most, hogy van tömény kénsavunk, végrehajthatjuk az alapreakciót, így néz ki:
Előbb azonban végezzünk néhány számítást, és a végén összevetjük a gyakorlatban történtekkel.
Tehát kezdetben 200 ml elektrolitunk volt, sűrűsége 1,27 g/cm³. A kénsav sűrűségeinek táblázatát tekintve azt látjuk, hogy ez a sűrűség 36%-os koncentrációnak felel meg. Számítsuk ki a sav térfogatát:
200 ml * 36% = 72 ml - V (H2SO4)
Miután bepároltuk az oldatot, nőtt a koncentrációja, így a sűrűsége. Megnézzük ugyanazt a táblázatot, és azt látjuk, hogy a 75%-os koncentráció 1,67 g/cm³ sűrűségnek felel meg.
A sav áramsűrűségének (p) és térfogatának (V) ismeretében megtudjuk a tömeget:
m=p*V;
m(H2SO4) = 1,67 g/cm3 * 72 ml = 120 g;
m(H2SO4) = 1,67 g/cm3 * 72 ml = 120 g;
Most emlékszünk az iskolai kémiából:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
ahol M az anyag moláris tömege.
ahol M az anyag moláris tömege.
A H2SO4, NaCl és HCl moláris tömege 98, 58,5 és 36,5 g/mol. Most megtudhatjuk, mennyi konyhasóra van szükség, és mennyi HCl-t kapunk.
Ugyanis 72 g NaCl-ra van szükségünk, ez 34 ml, vegyük feleslegben - negyed pohárral.
Nagyszerű, és a HCl elméletileg 44,7 g lesz.
A HCl sűrűségtáblázatban van egy g/l oszlop. Innen vesszük a 15% - 166,4 g/l koncentráció értéket. A 15%-os HCl előállításához szükséges víz térfogata 44,7/166,4≈270 ml. 200 ml-t veszünk. Ennek eredményeként elméletileg 22%-os sósavat fogok kapni.
3. szakasz - sav előállítása
A két sarkot a következőképpen kötjük össze:
És az egész szerkezet így fog kinézni:
A megfelelő sav egy HCl feliratú edénybe kondenzálódik, a benne lévő víz térfogata 200 ml. Ezen a tartályon jelölje meg az aktuális folyadékszintet is.
A sarkokat eltávolítjuk, és egy tölcséren keresztül öntsük a lombikba a számított sómennyiséget.
Az oldat sárgává válik.
Ahhoz, hogy a sósav elkezdjen felszabadulni, be kell kapcsolnia az égőt. De először szorosan rögzítjük a sarkokat a lombikhoz és a fogadóedényhez.
Amikor a sav lecsapódik a vízben, „függőleges hullámok” keletkeznek. Ezenkívül az oldat felmelegszik, és le kell hűteni. Például elhelyezhet egy másik edényt jéggel.
A reakció viszonylag gyorsan lezajlik - 20 perc, ezután kikapcsolhatja a hőt. Hagyja feloldódni a sósav utolsó gőzeit a vízben, majd zárja le hermetikusan az edényt. Amikor a lombik kihűlt, hígítsa fel a maradék oldatot vízzel (kb. egy az egyhez), és öntse a csatornába.
A lényeg
Az edényen lévő jelzés alapján határozzuk meg, hogy mennyi folyadékot adtunk hozzá. Nálam ez ⅙, azaz 17%. Ez a sósavunk koncentrációja. Hasonlítsuk össze az elméletben kapottal.
17%/22%*100%=77% - reakcióhozam.
Fontos megjegyezni, hogy nincs 1-gyel egyenlő kimenet, mindig vannak veszteségek. Az én esetemben ez egy nem kellően elpárolgott elektrolit. Ideális esetben a kénsav koncentrációja 90-95% legyen.
Vizsgáljuk meg, hogy a kapott sav kölcsönhatásba lép-e fémmel.
A hidrogén gyors fejlődését figyeljük meg. Ez azt jelenti, hogy a sav alkalmas további kísérletekre.
Variációk
Használhat tiszta üveg sört vagy üdítős üveget lombikként, de feltéve, hogy a melegítés a lehető legsimább legyen. PVC sarkok helyett polipropilén csöveket és kisebb átmérőjű sarkokat is használhat (az Ön lombikjához megfelelő).
Még egyszer kérem, hogy tartsa be a biztonsági óvintézkedéseket. Boldog élményeket mindenkinek!
Hasonló mesterkurzusok
Különösen érdekes
Megjegyzések (19)