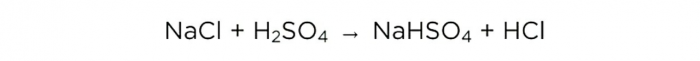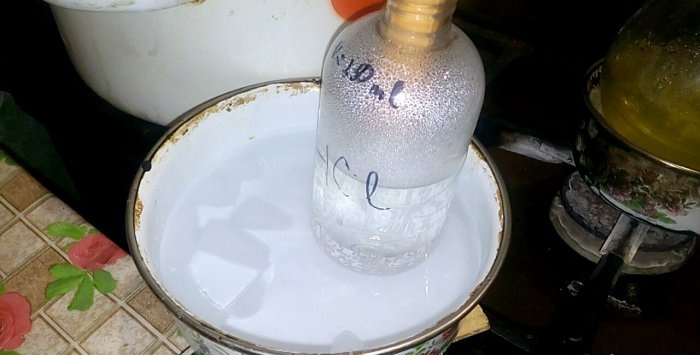Preparare l'acido cloridrico in casa
Gli alchimisti che per primi produssero l’acido cloridrico nel XV secolo lo chiamarono “spiritus salis”, “spirito del sale”. A quel tempo, questo acido aveva proprietà magiche: corrodeva la carta, dissolveva i metalli e avvelenava le persone. Queste proprietà rimangono fino ad oggi, ma ora questo acido è stato sufficientemente studiato e qui non c'è magia.
L'acido cloridrico (HCl) è un acido monobasico forte, nella sua forma pura è un liquido trasparente. Alla sua concentrazione massima del 38% “fuma” nell'aria. Riceveremo acido con una concentrazione pari alla metà.
Quindi iniziamo.
Misure di sicurezza
Fai attenzione quando lavori con sostanze tossiche!
Tutti gli esperimenti devono essere eseguiti in una stanza ben ventilata o sotto una cappa. Assicurati di indossare occhiali protettivi (acquistabili in un negozio di ferramenta) e guanti (se non riesci a trovare guanti chimici speciali, sono adatti quelli di buona qualità per lavare i piatti).
Il bicarbonato di sodio deve essere presente nel luogo dell'esperimento per neutralizzare l'acido in una situazione imprevista (questo rilascerà anidride carbonica e acqua).
È severamente vietato condurre esperimenti in contenitori metallici.
Avrà bisogno
Per condurre l'esperimento avremo bisogno di:
- Elettrolita acido per batterie (venduto in un negozio di automobili);
- Acqua distillata (ibid);
- Sale da cucina (disponibile in qualsiasi cucina);
- Bicarbonato di sodio (vedi precauzioni di sicurezza).
Dai piatti di cui hai bisogno:
- Boccetta di vetro;
- Un recipiente con sabbia dove riporre la fiaschetta;
- Diverse tazze usa e getta da 200 ml;
Se disponi di una borraccia resistente al calore, puoi scaldarla sotto la fiamma libera di un fornello. Ma consiglio comunque di usare la sabbia, nel qual caso assorbirà l'acido.
Avrai bisogno anche di una coppia di angoli idraulici con un diametro di 50 mm e di un bruciatore (nel mio caso alcool, ma consiglio di usare uno a gas).
Fase 1: evaporazione
L'elettrolito per le batterie è acido solforico al 36% (H2SO4). Per prima cosa dobbiamo aumentare la sua concentrazione.
Versare nel bicchiere 200 ml, cioè quasi fino all'orlo, e versare nel fiasco poco più della metà del bicchiere. Fai un segno con un pennarello e aggiungi il resto.
Ho posizionato un riflettore di alluminio attorno alla beuta per un riscaldamento più efficiente, ma in seguito l'ho rimosso perché iniziava a sciogliersi.
Ora mettete il pallone sul fuoco e fate evaporare fino al livello della tacca precedentemente impostata, anche un po' più in basso.
Allo stesso tempo, mettiamo una garza piegata più volte sull'angolo e la fissiamo con un elastico. Preparare una soluzione di soda insatura e immergervi l'estremità dell'angolo con una garza.
Quando l'elettrolito inizia a bollire, mettiamo un angolo sul pallone, ci aderisce saldamente. Dirigiamo l'estremità della garza nella finestra aperta.
Ciò è necessario se improvvisamente l'acido solforico stesso inizia ad evaporare insieme all'acqua. Se non surriscaldi troppo la fiaschetta, questo non accadrà.
Bruciatore in funzione:
Il mio bruciatore ha una potenza relativamente bassa, quindi l'evaporazione ha richiesto circa un'ora.Un fornello a gas o un fornello elettrico accelererebbe notevolmente questo processo.
Dopo aver completato la prima fase, nel pallone dovrebbe rimanere poco meno della metà della soluzione, cioè un acido con una concentrazione di circa il 75%. Non dimenticare la precisione.
Lasciarlo raffreddare a temperatura ambiente.
Fase 2: calcoli
Ora che abbiamo concentrato l'acido solforico, possiamo eseguire la reazione di base, che assomiglia a questa:
Ma prima facciamo qualche calcolo, e alla fine li confronteremo con quanto accaduto nella pratica.
Quindi inizialmente avevamo 200 ml di elettrolita con una densità di 1,27 g/cm³. Osservando la tabella delle densità dell'acido solforico, vediamo che questa densità corrisponde ad una concentrazione del 36%. Calcoliamo il volume dell'acido:
200ml*36%=72ml-V(H2SO4)
Dopo aver evaporato la soluzione, la sua concentrazione, e quindi la sua densità, è aumentata. Osserviamo la stessa tabella e vediamo che una concentrazione del 75% corrisponde ad una densità di 1,67 g/cm³.
Conoscendo la densità attuale (p) e il volume (V) dell'acido, troviamo la massa:
m=p*V;
m(H2SO4)=1,67 g/cm³ * 72 ml=120 g;
m(H2SO4)=1,67 g/cm³ * 72 ml=120 g;
Ora ricordiamo dalla chimica scolastica:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
dove M è la massa molare della sostanza.
dove M è la massa molare della sostanza.
Le masse molari di H2SO4, NaCl e HCl sono rispettivamente 98, 58,5 e 36,5 g/mol. Ora possiamo scoprire quanto sale da cucina è necessario e quanto HCl otterremo.
Vale a dire, abbiamo bisogno di 72 g di NaCl, ovvero 34 ml, prendiamolo in eccesso: un quarto di bicchiere.
Ottimo, e l'HCl in teoria arriverà a 44,7 g.
La tabella della densità dell'HCl ha una colonna g/l. Da lì prendiamo il valore per una concentrazione del 15% - 166,4 g/l. Il volume di acqua richiesto per ottenere HCl al 15% è 44,7/166,4≈270 ml. Prenderemo 200 ml. Di conseguenza, in teoria, otterrò acido cloridrico al 22%.
Fase 3: ottenere l'acido
Colleghiamo i due angoli come segue:
E l'intera struttura sarà simile a questa:
L'acido corrispondente si condenserà in un recipiente etichettato HCl; il volume d'acqua al suo interno è di 200 ml. Contrassegnare anche il livello attuale del liquido su questo contenitore.
Togliamo gli angoli e attraverso un imbuto versiamo nel fiasco la quantità calcolata di sale.
La soluzione diventa gialla.
Affinché l'acido cloridrico inizi a rilasciare, è necessario accendere il bruciatore. Ma prima fissiamo saldamente gli angoli al pallone e alla nave ricevente.
Quando l’acido si condensa nell’acqua si formano le “onde verticali”. Inoltre, la soluzione si riscalda e deve essere raffreddata. Ad esempio, puoi posizionare un'altra nave con ghiaccio sotto.
La reazione procede in tempi relativamente brevi: 20 minuti, dopodiché è possibile spegnere il fuoco. Lasciare sciogliere nell'acqua gli ultimi vapori dell'acido cloridrico, quindi chiudere ermeticamente il recipiente. Quando il pallone si sarà raffreddato, diluire la soluzione rimanente con acqua (circa uno a uno) e versarla nella fogna.
Linea di fondo
Dal segno sul recipiente determiniamo quanto liquido è stato aggiunto. Per me è ⅙, cioè il 17%. Questa è la concentrazione del nostro acido cloridrico. Confrontiamolo con quello ottenuto in teoria.
17%/22%*100%=77% - resa della reazione.
È importante notare che non esiste una produzione pari a 1, ci sono sempre perdite. Nel mio caso, questo è un elettrolita non sufficientemente evaporato. Idealmente, la concentrazione di acido solforico dovrebbe essere del 90-95%.
Controlliamo l'interazione dell'acido risultante con il metallo.
Osserviamo una rapida evoluzione dell'idrogeno. Ciò significa che l'acido è adatto per ulteriori esperimenti.
Variazioni
Puoi usare una bottiglia di birra o soda in vetro pulita come fiaschetta, ma a condizione che il riscaldamento sia il più graduale possibile. Invece degli angoli in PVC, puoi prendere tubi e angoli in polipropilene di diametro inferiore (adatti alla tua beuta).
Ancora una volta vi esorto a seguire le precauzioni di sicurezza. Buone esperienze a tutti!
Masterclass simili
Particolarmente interessante
Commenti (19)