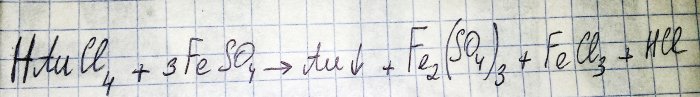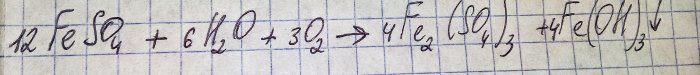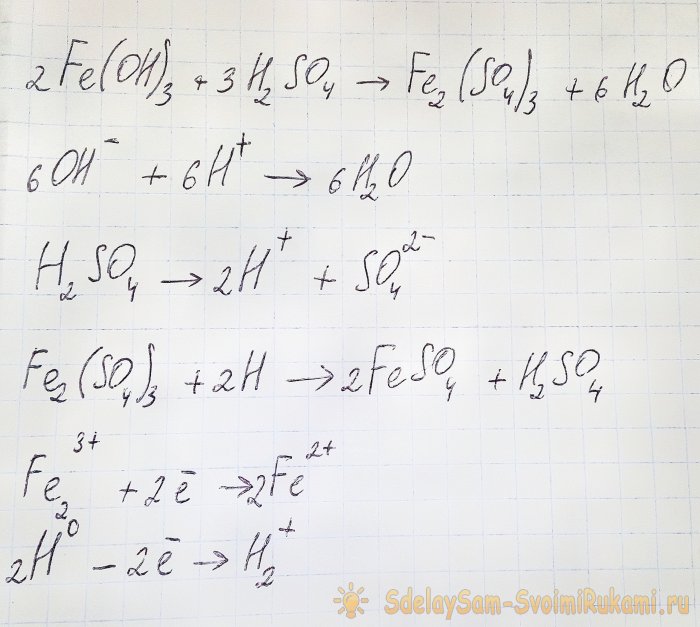Un modo rapido per ottenere solfato ferroso dal fertilizzante
Il penultimo passo nel percorso per ottenere un metallo nobile dai componenti radio è la riduzione di quest'ultimo dal corrispondente cloruro. Il solfato di ferro (II) è eccellente per questi scopi. Considera l'equazione per questa reazione:
HAuCl4 - idrogeno tetracloroaurato (III) - un composto che si forma quando l'oro viene sciolto nell'acqua regia. Per ora non approfondiremo questo processo perché meriterebbe un articolo a parte.
Quindi, il solfato (di seguito si intende solfato di ferro (II)) è uno degli agenti riducenti economici e facilmente disponibili. Nei negozi lo si trova sotto il nome di “solfato di ferro”, è un fertilizzante. Ma questa non è una sostanza pura, la percentuale di solfato in essa contenuta è di circa il 50%, il resto sono impurità. E prima di poter ripristinare l'oro, dobbiamo purificare il nostro solfato.
Avrà bisogno
Per questo avrai bisogno di:
- Solfato di ferro (venduto nei negozi come “tutto per il giardino”; ho comprato un chilogrammo per averne abbastanza per la testa);
- Soluzione di acido solforico, noto anche come elettrolita acido per batterie (nelle concessionarie di automobili);
- Alcool, ho usato il 95%;
- Stoviglie chimiche o monouso (tazze, cucchiai per mescolare).
Otteniamo il solfato di ferro dal fertilizzante
Per preparare la soluzione utilizzo un barattolo di vetro. All'interno ci sono 500 ml di acqua calda, forse un po' meno.
Ora dosate circa mezzo bicchiere di fertilizzante:
Come puoi vedere, la sostanza è di colore giallo-marrone; tale "solfato" sporco può essere utilizzato solo per lo scopo previsto: spruzzare la vegetazione. Abbiamo altri obiettivi.
Versalo nel barattolo:
La soluzione ha assunto uno sgradevole colore marrone. La colorazione è avvenuta a causa della reazione del fertilizzante con l'acqua:
Il ferro nel solfato viene ossidato in trivalente e precipita l'idrossido di ferro (III), che in realtà è la ragione del suo colore.
Per ottenere dai composti risultanti il solfato di nostro interesse è necessario acidificare la soluzione con acido solforico. Aggiungere in piccole porzioni finché la soluzione non diventa più luminosa.
In questo caso si verificano le seguenti reazioni:
L'idrossido reagisce con l'acido per formare solfato di ferro (III) (reazione di scambio ionico). A sua volta reagisce con l'idrogeno atomico, che si forma durante la dissociazione dell'acido solforico. L'ultima reazione è redox.
Ora la soluzione contiene esattamente il solfato di cui abbiamo bisogno, ma la soluzione stessa è ancora torbida. Lascia riposare e filtralo, io ho usato un filtro chimico.
Sul fondo del barattolo sono rimaste impurità insolubili:
Lo sciacquiamo e vi versiamo la soluzione filtrata. È molto più leggero e pulito dell'originale.
L'alcol etilico sposta i sali degli acidi dibasici dalle loro soluzioni. Utilizzeremo questa proprietà per ottenere solfato solido. Aggiungiamo alcol alla soluzione, io ho versato 200 ml, che in volume è pari a poco più della metà del volume originale del fertilizzante.
Sul fondo sono comparsi i cristalli del nostro solfato.
Ho lasciato la soluzione per due giorni in modo che tutto il solfato avesse il tempo di precipitare.
Inizialmente puoi aggiungere più alcol per rendere questo processo più veloce.
Scolare il liquido, picchiettando sul fondo e riscaldando leggermente, separare il solfato dal barattolo e versarlo su un tovagliolo di carta ad asciugare.
Dopo alcune ore, versare il solfato in un barattolo di vetro, etichettare la sostanza e in questa forma può essere conservata a lungo.
Poiché precipitano idrati cristallini, la formula della sostanza è come in figura. Ma questo non ci impedisce di utilizzarlo per i nostri scopi, sciogliendolo comunque in acqua.
Conclusione
Le precauzioni di sicurezza e il rispetto delle regole per la manipolazione degli acidi sono un dato di fatto. In nessun caso dovremmo dimenticarcene.
Sostanze pulite a tutti!
Masterclass simili
Particolarmente interessante
Commenti (1)