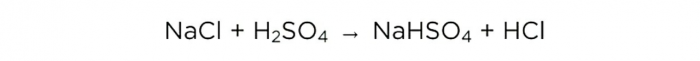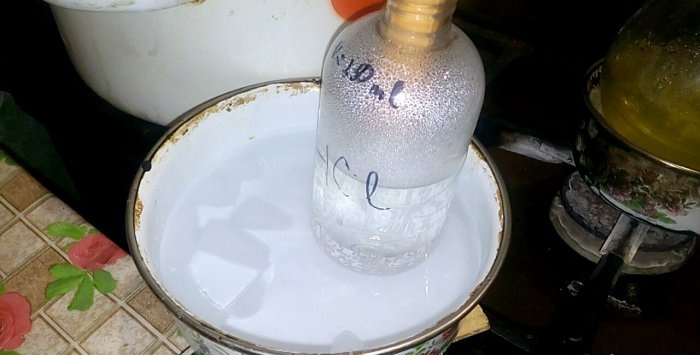הכנת חומצה הידרוכלורית בבית
אלכימאים שייצרו לראשונה חומצה הידרוכלורית במאה ה-15 כינו אותה "ספיריטוס סליס", "רוח ממלח". באותה תקופה, לחומצה זו היו תכונות קסומות: היא כילתה נייר, המסה מתכות והרעילה אנשים. התכונות הללו נשארות איתו עד היום, אבל עכשיו החומצה הזו נחקרה מספיק, ואין כאן קסם.
חומצה הידרוכלורית (HCl) היא חומצה מונו-בסיסית חזקה, בצורתה הטהורה היא נוזל שקוף. בריכוזו המרבי של 38% הוא "מעשן" באוויר. נקבל חומצה בריכוז של חצי מזה.
אז בואו נתחיל.
אמצעי בטיחות
היזהר בעבודה עם חומרים רעילים!
כל הניסויים חייבים להתבצע בחדר מאוורר היטב או מתחת למכסה מנוע הקפידו להרכיב משקפי בטיחות (ניתן לרכוש בחנות לחומרי בניין) וכפפות (אם לא מוצאים כפפות כימיות מיוחדות, מתאימות כאלו באיכות טובה לשטיפת כלים).
סודה לשתייה חייבת להיות במקום הניסוי על מנת לנטרל את החומצה במצב בלתי צפוי (זה ישחרר פחמן דו חמצני ומים).
חל איסור מוחלט לבצע ניסויים במיכלי מתכת.
יצטרך
כדי לבצע את הניסוי נצטרך:
- אלקטרוליט חומצי לסוללות (נמכר בחנות רכב);
- מים מזוקקים (שם);
- מלח שולחן (זמין בכל מטבח);
- סודה לשתייה (ראה אמצעי בטיחות).
מהמנות שאתה צריך:
- בקבוק זכוכית;
- כלי עם חול שבו אתה יכול להניח את הבקבוק;
- מספר כוסות חד פעמיות 200 מ"ל;
אם יש לך בקבוק עמיד בחום, אתה יכול לחמם אותו תחת הלהבה הפתוחה של מבער. אבל אני עדיין ממליץ להשתמש בחול, במקרה זה הוא יספוג חומצה.
תצטרך גם זוג זוויות אינסטלציה בקוטר 50 מ"מ ומבער (במקרה שלי אלכוהול, אבל אני ממליץ להשתמש בגז).
שלב 1 - אידוי
האלקטרוליט לסוללות הוא 36% חומצה גופרתית (H2SO4). ראשית עלינו להגביר את הריכוז שלו.
מוזגים 200 מ"ל לכוס, כלומר כמעט עד הסוף, ומוזגים קצת יותר ממחצית הכוס לבקבוק. סמן עם טוש והוסף את השאר.
הנחתי משקף נייר כסף סביב הבקבוק לחימום יעיל יותר, אבל מאוחר יותר הסרתי אותו כי הוא התחיל להמיס.
כעת הניחו את הבקבוק על המבער ואדו עד לרמת הסימן שהוגדר קודם לכן, אפילו מעט נמוך יותר.
במקביל, שמנו גזה מקופלת מספר פעמים בפינה ומאבטחים אותה עם רצועה אלסטית. הכינו תמיסת סודה בלתי רוויה וטבלו את קצה הפינה עם גזה לתוכה.
כשהאלקטרוליט מתחיל לרתוח, שמנו פינה על הבקבוק, הוא יושב עליו בחוזקה. אנו מכוונים את קצה הגזה אל החלון הפתוח.
זה הכרחי אם לפתע החומצה הגופרית עצמה מתחילה להתאדות יחד עם המים. אם לא תחמם את הבקבוק יותר מדי, זה לא יקרה.
מבער בפעולה:
המבער שלי בעל הספק נמוך יחסית, אז האידוי לקח כשעה.מבער גז או כיריים חשמליות יאיץ תהליך זה בצורה משמעותית.
לאחר השלמת השלב הראשון צריך להישאר בבקבוק קצת פחות ממחצית התמיסה, כלומר חומצה בריכוז של כ-75%. אל תשכח את הדיוק.
תן לזה להתקרר לטמפרטורת החדר.
שלב 2 - חישובים
כעת, לאחר ריכוז חומצה גופרתית, אנו יכולים לבצע את התגובה הבסיסית, זה נראה כך:
אבל קודם נעשה כמה חישובים, ובסוף נשווה אותם למה שקרה בפועל.
אז, בהתחלה היו לנו 200 מ"ל של אלקטרוליט עם צפיפות של 1.27 גרם/ס"מ³. בהסתכלות על טבלת הצפיפויות של חומצה גופרתית, אנו רואים שצפיפות זו מתאימה לריכוז של 36%. בוא נחשב את נפח החומצה:
200 מ"ל*36%=72 מ"ל - V(H2SO4)
לאחר שאידוי את התמיסה, הריכוז שלה, ולכן הצפיפות שלה, גדל. אנו מסתכלים על אותה טבלה ורואים שריכוז של 75% מתאים לצפיפות של 1.67 גרם/ס"מ³.
בידיעה של צפיפות הזרם (p) ונפח (V) של החומצה, אנו מגלים את המסה:
m=p*V;
m(H2SO4)=1.67g/cm³ * 72ml=120g;
m(H2SO4)=1.67g/cm³ * 72ml=120g;
עכשיו אנחנו זוכרים מהכימיה בבית הספר:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
כאשר M היא המסה המולרית של החומר.
כאשר M היא המסה המולרית של החומר.
המסות המולריות של H2SO4, NaCl ו-HCl הן 98, 58.5 ו-36.5 גרם/מול, בהתאמה. כעת נוכל לגלות כמה מלח שולחן צריך וכמה HCl נקבל.
כלומר, אנחנו צריכים 72 גרם של NaCl, זה 34 מ"ל, בואו ניקח את זה עודף - רבע כוס.
נהדר, ו-HCl בתיאוריה ייצא ל-44.7 גרם.
לטבלת צפיפות HCl יש עמודה g/l. אנחנו לוקחים משם את הערך לריכוז של 15% - 166.4 גרם/ליטר. נפח המים הנדרש להשגת 15% HCl הוא 44.7/166.4≈270 מ"ל. ניקח 200 מ"ל. כתוצאה מכך, בתיאוריה, אקבל 22% חומצה הידרוכלורית.
שלב 3 - קבלת חומצה
אנו מחברים את שתי הפינות באופן הבא:
והמבנה כולו ייראה כך:
החומצה המתאימה תתעבה לכלי המסומן HCl; נפח המים בו הוא 200 מ"ל. סמן גם את מפלס הנוזל הנוכחי על מיכל זה.
אנו מסירים את הפינות ויוצקים את כמות המלח המחושבת לתוך הבקבוק דרך משפך.
הפתרון הופך צהוב.
כדי שחומצת הידרוכלורית תתחיל להשתחרר, אתה צריך להפעיל את המבער. אבל ראשית, אנו מחברים בחוזקה את הפינות לבקבוק ולכלי המקבל.
כאשר חומצה מתעבה במים, נוצרים "גלים אנכיים". כמו כן, התמיסה מתחממת ויש לקרר אותה. לדוגמה, אתה יכול להניח כלי נוסף עם קרח למטה.
התגובה ממשיכה מהר יחסית - 20 דקות, לאחר מכן ניתן לכבות את האש. הניחו לאדים האחרונים של חומצה הידרוכלורית להתמוסס במים, ולאחר מכן אטמו את הכלי בצורה הרמטית. כאשר הבקבוק התקרר, יש לדלל את התמיסה שנותרה במים (בערך אחד לאחד) ולשפוך אותה לביוב.
שורה תחתונה
לפי הסימון על הכלי אנו קובעים כמה נוזלים נוספו. עבורי זה ⅙, כלומר 17%. זהו הריכוז של חומצת המלח שלנו. הבה נשווה את זה לזה שהתקבל בתיאוריה.
17%/22%*100%=77% - תפוקת תגובה.
חשוב לציין שאין תפוקה שווה ל-1, תמיד יש הפסדים. במקרה שלי, זה אלקטרוליט לא מספיק אידוי. באופן אידיאלי, הריכוז של חומצה גופרתית צריך להיות 90-95%.
בואו נבדוק את החומצה המתקבלת לאינטראקציה עם מתכת.
אנו רואים התפתחות מהירה של מימן. המשמעות היא שהחומצה מתאימה לניסויים נוספים.
וריאציות
ניתן להשתמש בבקבוק בירה או סודה נקי מזכוכית כבקבוק, אך בתנאי שהחימום יהיה חלק ככל האפשר. במקום פינות PVC, אתה יכול לקחת צינורות פוליפרופילן ופינות בקוטר קטן יותר (מתאים לבקבוק שלך).
שוב אני קורא לך לפעול על פי אמצעי הבטיחות. חוויות שמחות לכולם!
כיתות אמן דומות
מעניין במיוחד
הערות (19)