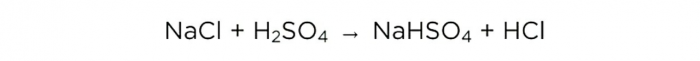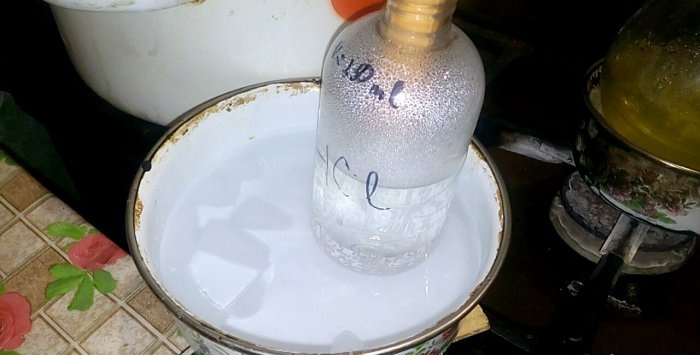Sālsskābes pagatavošana mājās
Alķīmiķi, kas 15. gadsimtā pirmo reizi ražoja sālsskābi, to sauca par “spiritus salis”, “spirtu no sāls”. Tolaik šai skābei bija maģiskas īpašības: tā korodēja papīru, šķīdināja metālus, saindēja cilvēkus. Šīs īpašības saglabājušās līdz mūsdienām, taču tagad šī skābe ir pietiekami izpētīta, un šeit nav nekādas maģijas.
Sālsskābe (HCl) ir spēcīga vienbāziska skābe, tīrā veidā tā ir caurspīdīgs šķidrums. Pie maksimālās koncentrācijas 38% tas “smēķē” gaisā. Mēs saņemsim skābi ar koncentrāciju uz pusi mazākas.
Tātad sāksim.
Drošības pasākumi
Esiet uzmanīgi, strādājot ar toksiskām vielām!
Visi eksperimenti jāveic labi vēdināmā telpā vai zem pārsega Noteikti jāvalkā aizsargbrilles (var iegādāties datortehnikas veikalā) un cimdi (ja nevarat atrast speciālos ķīmiskos cimdus, der labas kvalitātes cimdi). trauku mazgāšanai).
Eksperimenta vietā ir jābūt cepamajai sodai, lai neparedzētā situācijā neitralizētu skābi (tas izdalīs oglekļa dioksīdu un ūdeni).
Ir stingri aizliegts veikt eksperimentus metāla traukos.
Vajadzēs
Lai veiktu eksperimentu, mums būs nepieciešams:
- Skābais elektrolīts akumulatoriem (pārdod auto veikalā);
- Destilēts ūdens (turpat);
- galda sāls (pieejams jebkurā virtuvē);
- Cepamā soda (skatīt drošības pasākumus).
No nepieciešamajiem ēdieniem:
- Stikla kolba;
- Trauks ar smiltīm, kur var novietot kolbu;
- Vairākas vienreizējās lietošanas krūzes 200 ml;
Ja jums ir karstumizturīga kolba, varat to sildīt zem degļa atklātas liesmas. Bet tomēr iesaku izmantot smiltis, tādā gadījumā tās uzsūks skābi.
Vajadzēs arī pāris santehnikas leņķus ar diametru 50mm un degli (manā gadījumā spirtu, bet iesaku izmantot gāzes).
1. posms - iztvaikošana
Akumulatoru elektrolīts ir 36% sērskābe (H2SO4). Vispirms mums jāpalielina tā koncentrācija.
Ielejiet glāzē 200 ml, tas ir, gandrīz līdz malai, un ielejiet kolbā nedaudz vairāk par pusi glāzes. Atzīmējiet ar marķieri un pievienojiet pārējo.
Apkārt kolbai novietoju folijas reflektoru, lai tā būtu efektīvāka sildīšana, bet vēlāk to noņēmu, jo sāka kust.
Tagad uzlieciet kolbu uz degļa un iztvaicē līdz iepriekš iestatītās atzīmes līmenim, pat nedaudz zemākam.
Tajā pašā laikā uz stūra uzliekam vairākas reizes salocītu marli un nostiprinām ar elastīgo joslu. Sagatavojiet nepiesātināto sodas šķīdumu un iemērciet tajā stūra galu ar marli.
Kad elektrolīts sāk vārīties, mēs uzliekam stūri uz kolbas, tas cieši sēž uz tā. Mēs virzām marles galu atvērtajā logā.
Tas ir nepieciešams, ja pēkšņi kopā ar ūdeni sāk iztvaikot arī pati sērskābe. Ja jūs nepārkarsējat kolbu pārāk daudz, tas nenotiks.
Deglis darbībā:
Manam deglim ir salīdzinoši maza jauda, tāpēc iztvaikošana ilga apmēram stundu.Gāzes deglis vai elektriskā plīts šo procesu ievērojami paātrinātu.
Pēc pirmā posma pabeigšanas kolbā jāpaliek nedaudz mazāk nekā pusei šķīduma, tas ir, skābei ar koncentrāciju aptuveni 75%. Neaizmirstiet par precizitāti.
Ļaujiet tai atdzist līdz istabas temperatūrai.
2. posms - aprēķini
Tagad, kad mums ir koncentrēta sērskābe, mēs varam veikt pamata reakciju, tā izskatās šādi:
Bet vispirms veiksim dažus aprēķinus, un beigās mēs tos salīdzināsim ar praksē notikušo.
Tātad sākotnēji mums bija 200 ml elektrolīta ar blīvumu 1,27 g/cm³. Aplūkojot sērskābes blīvumu tabulu, mēs redzam, ka šis blīvums atbilst 36% koncentrācijai. Aprēķināsim skābes tilpumu:
200 ml * 36% = 72 ml — V(H2SO4)
Pēc šķīduma iztvaicēšanas tā koncentrācija un līdz ar to arī blīvums palielinājās. Mēs skatāmies uz to pašu tabulu un redzam, ka 75% koncentrācija atbilst blīvumam 1,67 g/cm³.
Zinot skābes strāvas blīvumu (p) un tilpumu (V), mēs uzzinām masu:
m=p*V;
m(H2SO4) = 1,67 g/cm³ * 72 ml = 120 g;
m(H2SO4) = 1,67 g/cm³ * 72 ml = 120 g;
Tagad mēs atceramies no skolas ķīmijas:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
kur M ir vielas molārā masa.
kur M ir vielas molārā masa.
H2SO4, NaCl un HCl molārās masas ir attiecīgi 98, 58,5 un 36,5 g/mol. Tagad mēs varam uzzināt, cik daudz galda sāls ir nepieciešams un cik daudz HCl mēs saņemsim.
Proti, mums vajag 72 g NaCl, tas ir 34 ml, ņemsim to pārlieku - ceturtdaļu glāzes.
Lieliski, un HCl teorētiski iznāks līdz 44,7 g.
HCl blīvuma tabulā ir kolonna g/l. No turienes mēs ņemam vērtību koncentrācijai 15% - 166,4 g/l. Ūdens tilpums, kas nepieciešams, lai iegūtu 15% HCl, ir 44,7/166,4≈270 ml. Mēs ņemam 200 ml. Rezultātā teorētiski es iegūšu 22% sālsskābi.
3. posms - skābes iegūšana
Mēs savienojam divus stūrus šādi:
Un visa struktūra izskatīsies šādi:
Atbilstošā skābe kondensējas traukā ar marķējumu HCl; ūdens tilpums tajā ir 200 ml. Uz šī trauka atzīmējiet arī pašreizējo šķidruma līmeni.
Mēs noņemam stūrus un caur piltuvi ielejam kolbā aprēķināto sāls daudzumu.
Šķīdums kļūst dzeltens.
Lai sālsskābe sāktu izdalīties, jums jāieslēdz deglis. Bet vispirms mēs cieši piestiprinām stūrus pie kolbas un uztveršanas trauka.
Kad skābe kondensējas ūdenī, veidojas “vertikāli viļņi”. Arī šķīdums uzsilst un ir jāatdzesē. Piemēram, zemāk varat novietot citu trauku ar ledu.
Reakcija norit salīdzinoši ātri - 20 minūtes, pēc tam var izslēgt uguni. Ļaujiet pēdējiem sālsskābes tvaikiem izšķīst ūdenī un pēc tam hermētiski noslēdziet trauku. Kad kolba ir atdzisusi, atlikušo šķīdumu atšķaida ar ūdeni (apmēram viens pret vienu) un ielej kanalizācijā.
Apakšējā līnija
Pēc atzīmes uz trauka mēs nosakām, cik daudz šķidruma ir pievienots. Man tas ir ⅙, tas ir, 17%. Tā ir mūsu sālsskābes koncentrācija. Salīdzināsim to ar teorētiski iegūto.
17%/22%*100%=77% - reakcijas iznākums.
Ir svarīgi atzīmēt, ka nav izejas, kas vienāda ar 1, vienmēr ir zaudējumi. Manā gadījumā tas ir nepietiekami iztvaicēts elektrolīts. Ideālā gadījumā sērskābes koncentrācijai jābūt 90-95%.
Pārbaudīsim iegūtās skābes mijiedarbību ar metālu.
Mēs novērojam strauju ūdeņraža attīstību. Tas nozīmē, ka skābe ir piemērota turpmākiem eksperimentiem.
Variācijas
Kā kolbu varat izmantot tīru stikla pudeli alus vai sodas, bet ar nosacījumu, ka sildīšana ir pēc iespējas vienmērīgāka. PVC stūru vietā varat ņemt polipropilēna caurules un mazāka diametra stūrus (piemērots jūsu kolbai).
Vēlreiz aicinu ievērot drošības pasākumus. Priecīgu pieredzi visiem!
Līdzīgas meistarklases
Īpaši interesanti
Komentāri (19)