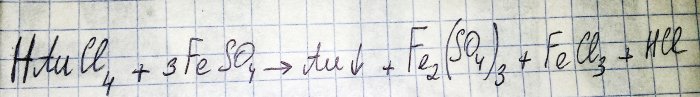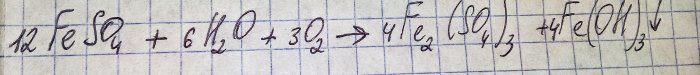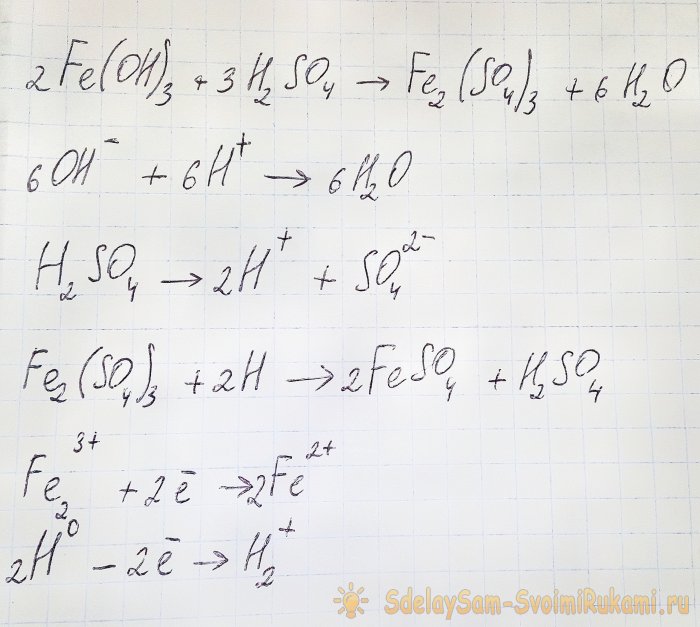Ātrs veids, kā iegūt dzelzs sulfātu no mēslojuma
Priekšpēdējais solis ceļā uz cēlmetāla iegūšanu no radio komponentiem ir tā reducēšana no atbilstošā hlorīda. Dzelzs (II) sulfāts ir lielisks šiem nolūkiem. Apsveriet šīs reakcijas vienādojumu:
HAuCl4 - ūdeņraža tetrahloraurāts (III) - savienojums, kas veidojas, zeltam izšķīdinot ūdens regijā. Mēs pagaidām neiedziļināsimies šajā procesā, jo tas ir pelnījis atsevišķu rakstu.
Tātad sulfāts (turpmāk ir domāts dzelzs(II) sulfāts) ir viens no lētajiem un viegli pieejamajiem reducētājiem. Veikalos to var atrast ar nosaukumu “dzelzs sulfāts”, tas ir mēslojums. Bet šī nav tīra viela, sulfāta īpatsvars tajā ir aptuveni 50%, pārējais ir piemaisījumi. Un pirms mēs varam atjaunot zeltu, mums ir jāattīra savs sulfāts.
Vajadzēs
Šim nolūkam jums būs nepieciešams:
- Dzelzs sulfāts (pārdod veikalos kā “viss dārzam”; nopirku kilogramu, lai galvai pietiktu);
- Sērskābes šķīdums, kas pazīstams arī kā skābes elektrolīts akumulatoriem (automašīnu tirdzniecības vietās);
- Alkohols, lietoju 95%;
- Ķīmiskie vai vienreizējās lietošanas trauki (krūzes, karotes maisīšanai).
Mēs iegūstam dzelzs sulfātu no mēslojuma
Šķīduma pagatavošanai izmantoju stikla burku. Iekšā ir 500 ml karsta ūdens, varbūt nedaudz mazāk.
Tagad izmēriet apmēram pusi glāzes mēslojuma:
Kā redzat, viela ir dzeltenbrūnā krāsā, šādu netīru “sulfātu” var izmantot tikai paredzētajam mērķim - veģetācijas izsmidzināšanai. Mums ir citi mērķi.
Ielejiet to burkā:
Šķīdums ieguva nepatīkamu brūnu krāsu. Krāsošana radās mēslošanas līdzekļa reakcijas dēļ ar ūdeni:
Dzelzs sulfātā tiek oksidēts līdz trīsvērtīgajam, un dzelzs (III) hidroksīds nogulsnējas, kas faktiski ir iemesls tā krāsai.
Lai no iegūtajiem savienojumiem iegūtu mūs interesējošo sulfātu, nepieciešams šķīdumu paskābināt ar sērskābi. Pievienojiet nelielās porcijās, līdz šķīdums kļūst gaišāks.
Šajā gadījumā rodas šādas reakcijas:
Hidroksīds reaģē ar skābi, veidojot dzelzs (III) sulfātu (jonu apmaiņas reakcija). Tas savukārt reaģē ar atomu ūdeņradi, kas veidojas sērskābes disociācijas laikā. Pēdējā reakcija ir redokss.
Tagad šķīdums satur tieši mums nepieciešamo sulfātu, bet pats šķīdums joprojām ir duļķains. Ļaujiet tai sēdēt un filtrējiet to, es izmantoju ķīmisko filtru.
Burkas apakšā palika nešķīstoši piemaisījumi:
Mēs to noskalojam un ielejam tajā filtrēto šķīdumu. Tas ir daudz vieglāks un tīrāks nekā oriģināls.
Etilspirts izspiež divbāzisko skābju sāļus no to šķīdumiem. Mēs izmantosim šo īpašību, lai iegūtu cieto sulfātu. Šķīdumam pievienojam spirtu, es ielēju 200 ml, kas pēc tilpuma ir vienāds ar nedaudz vairāk par pusi no sākotnējā mēslojuma tilpuma.
Apakšā parādījās mūsu sulfāta kristāli.
Es atstāju šķīdumu divas dienas, lai visam sulfātam būtu laiks nogulsnēties.
Sākotnēji varat pievienot vairāk alkohola, lai paātrinātu šo procesu.
Iztukšojiet šķidrumu, piesitot apakšai un viegli karsējot, atdaliet sulfātu no burkas un izlejiet to uz papīra dvieļa, lai nožūtu.
Pēc dažām stundām ielejiet sulfātu stikla burkā, marķējiet vielu, un šādā formā to var uzglabāt ilgu laiku.
Tā kā izgulsnējās kristāliskie hidrāti, vielas formula ir tāda, kā attēlā. Bet tas mums neliedz to izmantot saviem mērķiem, jebkurā gadījumā izšķīdinot ūdenī.
Secinājums
Drošības pasākumi un atbilstība noteikumiem par apiešanos ar skābēm ir noteikti. Nekādā gadījumā nedrīkstam par tiem aizmirst.
Tīras vielas visiem!
Līdzīgas meistarklases
Īpaši interesanti
Komentāri (1)