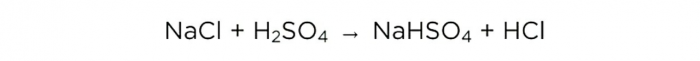Membuat asid hidroklorik di rumah
Ahli alkimia yang mula-mula menghasilkan asid hidroklorik pada abad ke-15 memanggilnya "spiritus salis," "semangat daripada garam." Pada masa itu, asid ini mempunyai sifat ajaib: ia menghakis kertas, logam terlarut, dan meracuni orang. Sifat-sifat ini kekal dengannya hingga ke hari ini, tetapi kini asid ini telah dikaji dengan secukupnya, dan tidak ada keajaiban di sini.
Asid hidroklorik (HCl) adalah asid monobes yang kuat, dalam bentuk tulen ia adalah cecair telus. Pada kepekatan maksimum 38% ia "merokok" di udara. Kami akan menerima asid dengan kepekatan separuh daripada itu.
Jadi mari kita mulakan.
Amaran keselamatan
Berhati-hati apabila bekerja dengan bahan toksik!
Semua eksperimen mesti dijalankan di dalam bilik yang mempunyai pengudaraan yang baik atau di bawah tudung. Pastikan memakai cermin mata keselamatan (boleh dibeli di kedai perkakasan) dan sarung tangan (jika anda tidak menemui sarung tangan kimia khas, yang berkualiti adalah sesuai untuk membasuh pinggan).
Soda penaik mesti ada di tapak eksperimen untuk meneutralkan asid dalam keadaan yang tidak dijangka (ini akan membebaskan karbon dioksida dan air).
Ia dilarang sama sekali untuk menjalankan eksperimen dalam bekas logam.
Akan memerlukan
Untuk menjalankan eksperimen kami memerlukan:
- Elektrolit asid untuk bateri (dijual di kedai kereta);
- Air suling (ibid);
- Garam meja (tersedia di mana-mana dapur);
- Soda penaik (lihat langkah berjaga-jaga keselamatan).
Dari hidangan yang anda perlukan:
- Kelalang kaca;
- Sebuah bekas dengan pasir di mana anda boleh meletakkan kelalang;
- Beberapa cawan pakai buang 200 ml;
Jika anda mempunyai kelalang tahan haba, anda boleh memanaskannya di bawah api terbuka penunu. Tetapi saya masih mengesyorkan menggunakan pasir, di mana ia akan menyerap asid.
Anda juga memerlukan sepasang sudut paip dengan diameter 50 mm dan penunu (dalam kes saya, alkohol, tetapi saya cadangkan menggunakan gas).
Peringkat 1 - penyejatan
Elektrolit untuk bateri ialah 36% asid sulfurik (H2SO4). Mula-mula kita perlu meningkatkan kepekatannya.
Tuangkan 200 ml ke dalam gelas, iaitu hampir ke tepi, dan tuangkan lebih sedikit daripada separuh gelas ke dalam kelalang. Buat tanda dengan penanda dan tambah yang lain.
Saya meletakkan reflektor foil di sekeliling kelalang untuk pemanasan yang lebih cekap, tetapi kemudian mengeluarkannya kerana ia mula cair.
Sekarang letakkan kelalang pada penunu dan sejat ke tahap tanda yang ditetapkan sebelum ini, walaupun sedikit lebih rendah.
Pada masa yang sama, kami meletakkan kain kasa yang dilipat beberapa kali di sudut dan mengikatnya dengan jalur elastik. Sediakan larutan soda tak tepu dan celupkan hujung sudut dengan kain kasa ke dalamnya.
Apabila elektrolit mula mendidih, kami meletakkan sudut pada kelalang, ia terletak dengan ketat di atasnya. Kami mengarahkan hujung kasa ke tingkap yang terbuka.
Ini adalah perlu jika tiba-tiba asid sulfurik itu sendiri mula menguap bersama dengan air. Jika anda tidak terlalu memanaskan kelalang, ini tidak akan berlaku.
Pembakar dalam tindakan:
Pembakar saya adalah watt yang agak rendah, jadi penyejatan mengambil masa kira-kira sejam.Penunu gas atau dapur elektrik akan mempercepatkan proses ini dengan ketara.
Selepas melengkapkan peringkat pertama, sedikit kurang daripada separuh larutan harus kekal di dalam kelalang, iaitu asid dengan kepekatan kira-kira 75%. Jangan lupa tentang ketepatan.
Biarkan ia sejuk pada suhu bilik.
Peringkat 2 - pengiraan
Sekarang bahawa kita mempunyai asid sulfurik pekat, kita boleh menjalankan tindak balas asas, ia kelihatan seperti ini:
Tetapi pertama, mari kita lakukan beberapa pengiraan, dan pada akhirnya kita akan membandingkannya dengan apa yang berlaku dalam amalan.
Jadi, pada mulanya kami mempunyai 200ml elektrolit dengan ketumpatan 1.27 g/cm³. Melihat jadual ketumpatan asid sulfurik, kita melihat bahawa ketumpatan ini sepadan dengan kepekatan 36%. Mari kita hitung isipadu asid:
200ml*36%=72ml - V(H2SO4)
Selepas kami menyejat larutan, kepekatannya, dan oleh itu ketumpatannya, meningkat. Kami melihat jadual yang sama dan melihat bahawa kepekatan 75% sepadan dengan ketumpatan 1.67 g/cm³.
Mengetahui ketumpatan semasa (p) dan isipadu (V) asid, kita mengetahui jisim:
m=p*V;
m(H2SO4)=1.67g/cm³ * 72ml=120g;
m(H2SO4)=1.67g/cm³ * 72ml=120g;
Sekarang kita ingat dari kimia sekolah:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
di mana M ialah jisim molar bahan itu.
di mana M ialah jisim molar bahan itu.
Jisim molar H2SO4, NaCl dan HCl masing-masing ialah 98, 58.5 dan 36.5 g/mol. Sekarang kita boleh mengetahui berapa banyak garam meja yang diperlukan dan berapa banyak HCl yang kita akan dapat.
Iaitu, kita memerlukan 72 g NaCl, itu 34 ml, mari kita ambil lebihan - seperempat gelas.
Hebat, dan HCl secara teori akan keluar kepada 44.7 g.
Jadual ketumpatan HCl mempunyai lajur g/l. Kami mengambil dari sana nilai untuk kepekatan 15% - 166.4 g/l. Isipadu air yang diperlukan untuk mendapatkan 15% HCl ialah 44.7/166.4≈270ml. Kami akan mengambil 200ml. Akibatnya, secara teori, saya akan mendapat 22% asid hidroklorik.
Peringkat 3 - mendapatkan asid
Kami menyambungkan dua sudut seperti berikut:
Dan keseluruhan struktur akan kelihatan seperti ini:
Asid yang sepadan akan terkondensasi ke dalam bekas berlabel HCl; isipadu air di dalamnya ialah 200 ml. Tandakan juga paras cecair semasa pada bekas ini.
Kami mengeluarkan sudut dan tuangkan jumlah garam yang dikira ke dalam kelalang melalui corong.
Larutan menjadi kuning.
Agar asid hidroklorik mula dilepaskan, anda perlu menghidupkan penunu. Tetapi pertama-tama, kami melekatkan sudut pada kelalang dan bekas penerima dengan ketat.
Apabila asid terpeluwap dalam air, "gelombang menegak" terbentuk. Juga, larutan memanaskan dan mesti disejukkan. Sebagai contoh, anda boleh meletakkan bekas lain dengan ais di bawah.
Reaksi berjalan agak cepat - 20 minit, selepas itu anda boleh mematikan api. Biarkan wap terakhir asid hidroklorik larut dalam air, dan kemudian tutup bekas itu secara hermetik. Apabila kelalang telah sejuk, cairkan larutan yang tinggal dengan air (anggaran satu hingga satu) dan tuangkan ke dalam pembetung.
Pokoknya
Dengan tanda pada kapal kita menentukan berapa banyak cecair yang telah ditambah. Bagi saya ia adalah ⅙, iaitu, 17%. Ini adalah kepekatan asid hidroklorik kami. Mari kita bandingkan dengan yang diperoleh secara teori.
17%/22%*100%=77% - hasil tindak balas.
Adalah penting untuk ambil perhatian bahawa tiada output sama dengan 1, sentiasa ada kerugian. Dalam kes saya, ini adalah elektrolit yang tidak cukup sejat. Sebaik-baiknya, kepekatan asid sulfurik hendaklah 90-95%.
Mari kita periksa asid yang terhasil untuk interaksi dengan logam.
Kami memerhatikan evolusi hidrogen yang pesat. Ini bermakna asid itu sesuai untuk eksperimen selanjutnya.
Variasi
Anda boleh menggunakan sebotol kaca bersih bir atau soda sebagai kelalang, tetapi dengan syarat pemanasan adalah selicin mungkin. Daripada sudut PVC, anda boleh mengambil paip polipropilena dan sudut diameter yang lebih kecil (sesuai untuk kelalang anda).
Sekali lagi saya menggesa anda untuk mematuhi langkah berjaga-jaga keselamatan. Pengalaman gembira semua orang!
Kelas induk yang serupa

Membuat asid hidroklorik di rumah

Mendapatkan DNA di rumah

Kaedah yang dipercepatkan untuk menghilangkan karat dengan larutan asid sitrik

Membuat fosfor di rumah

Cara murah untuk membersihkan palam pencucuh dan memanjangkan hayat perkhidmatannya

Bagaimana untuk membersihkan akhbar Perancis daripada deposit teh
Amat menarik
Komen (19)