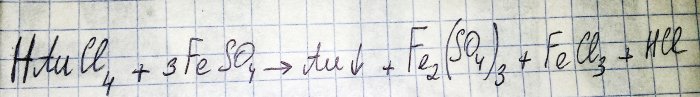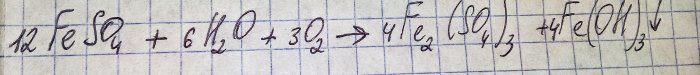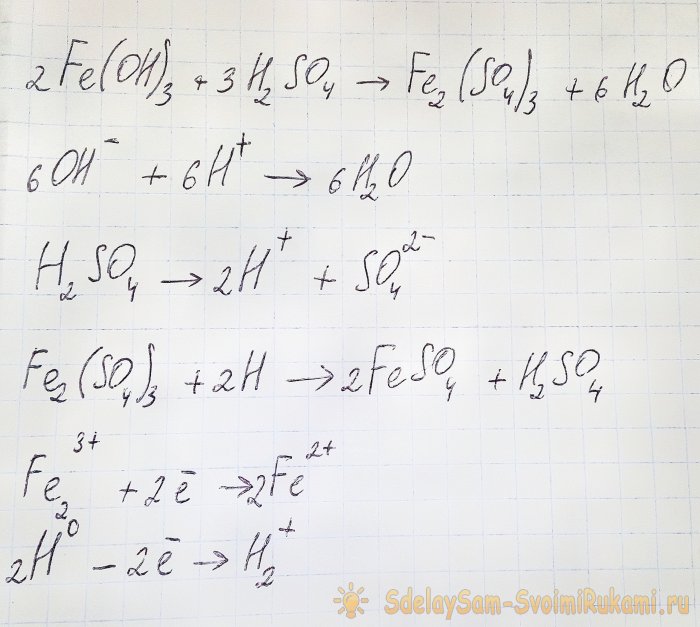Cara cepat untuk mendapatkan ferus sulfat daripada baja
Langkah terakhir pada laluan untuk mendapatkan logam mulia daripada komponen radio ialah pengurangan yang terakhir daripada klorida yang sepadan. Besi(II) sulfat adalah sangat baik untuk tujuan ini. Pertimbangkan persamaan untuk tindak balas ini:
HAuCl4 - hidrogen tetrakloroaurat (III) - sebatian yang terbentuk apabila emas dibubarkan dalam aqua regia. Kami tidak akan mendalami proses ini buat masa ini, kerana ia patut mendapat artikel yang berasingan.
Jadi, sulfat (selepas ini besi(II) sulfat dimaksudkan) adalah salah satu agen penurunan yang murah dan mudah didapati. Di kedai-kedai ia boleh didapati di bawah nama "besi sulfat", ia adalah baja. Tetapi ini bukan bahan tulen, bahagian sulfat di dalamnya adalah kira-kira 50%, selebihnya adalah kekotoran. Dan sebelum kita boleh memulihkan emas, kita perlu membersihkan sulfat kita.
Akan memerlukan
Untuk ini anda perlu:
- Besi sulfat (dijual di kedai seperti "segala-galanya untuk taman"; Saya membeli satu kilogram supaya saya mempunyai cukup untuk kepala saya);
- Larutan asid sulfurik, juga dikenali sebagai elektrolit asid untuk bateri (dalam pengedar kereta);
- Alkohol, saya menggunakan 95%;
- Pinggan mangkuk kimia atau pakai buang (cawan, sudu kacau).
Kami memperoleh besi sulfat daripada baja
Saya menggunakan balang kaca untuk menyediakan penyelesaian. Di dalamnya ada 500 ml air panas, mungkin kurang sedikit.
Sekarang ukur kira-kira setengah gelas baja:
Seperti yang anda lihat, bahan itu berwarna kuning-coklat; "sulfat" yang kotor itu hanya boleh digunakan untuk tujuan yang dimaksudkan - untuk menyembur tumbuh-tumbuhan. Kami mempunyai matlamat lain.
Tuangkan ke dalam balang:
Penyelesaiannya bertukar menjadi warna coklat yang tidak menyenangkan. Pewarnaan berlaku kerana tindak balas baja dengan air:
Besi dalam sulfat dioksidakan kepada trivalen, dan besi(III) hidroksida memendakan, yang sebenarnya adalah sebab untuk warnanya.
Untuk mendapatkan sulfat yang kita minati daripada sebatian yang terhasil, adalah perlu untuk mengasidkan larutan dengan asid sulfurik. Masukkan dalam bahagian kecil sehingga larutan menjadi cerah.
Dalam kes ini, tindak balas berikut berlaku:
Hidroksida bertindak balas dengan asid untuk membentuk besi(III) sulfat (tindak balas pertukaran ion). Ia seterusnya bertindak balas dengan hidrogen atom, yang terbentuk semasa penceraian asid sulfurik. Reaksi terakhir ialah redoks.
Sekarang penyelesaiannya mengandungi tepat sulfat yang kita perlukan, tetapi penyelesaian itu sendiri masih keruh. Biarkan ia duduk dan tapis, saya menggunakan penapis kimia.
Kekotoran tidak larut kekal di bahagian bawah balang:
Kami membilasnya dan tuangkan larutan yang ditapis ke dalamnya. Ia jauh lebih ringan dan bersih daripada yang asal.
Etil alkohol menyesarkan garam asid dibasic daripada larutannya. Kami akan menggunakan harta ini untuk mendapatkan sulfat pepejal. Kami menambah alkohol kepada larutan, saya menuangkan 200 ml, yang sama dengan jumlah sedikit lebih daripada separuh daripada jumlah baja asal.
Kristal sulfat kami muncul di bahagian bawah.
Saya meninggalkan penyelesaian selama dua hari supaya semua sulfat mempunyai masa untuk mendakan.
Anda boleh menambah lebih banyak alkohol pada mulanya untuk mempercepatkan proses ini.
Toskan cecair, menggunakan mengetuk di bahagian bawah dan pemanasan lembut, asingkan sulfat dari balang dan tuangkannya ke tuala kertas untuk kering.
Selepas beberapa jam, tuangkan sulfat ke dalam balang kaca, labelkan bahan itu, dan dalam bentuk ini ia boleh disimpan untuk masa yang lama.
Oleh kerana hidrat kristal memendakan, formula bahan adalah seperti dalam gambar. Tetapi ini tidak menghalang kita daripada menggunakannya untuk tujuan kita sendiri, melarutkannya dalam air pula.
Kesimpulan
Langkah berjaga-jaga keselamatan dan pematuhan peraturan untuk mengendalikan asid adalah diberikan. Dalam keadaan apa pun kita tidak boleh melupakan mereka.
Bahan bersih kepada semua orang!
Kelas induk yang serupa
Amat menarik
Komen (1)