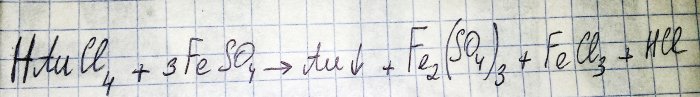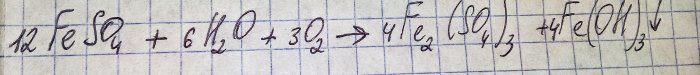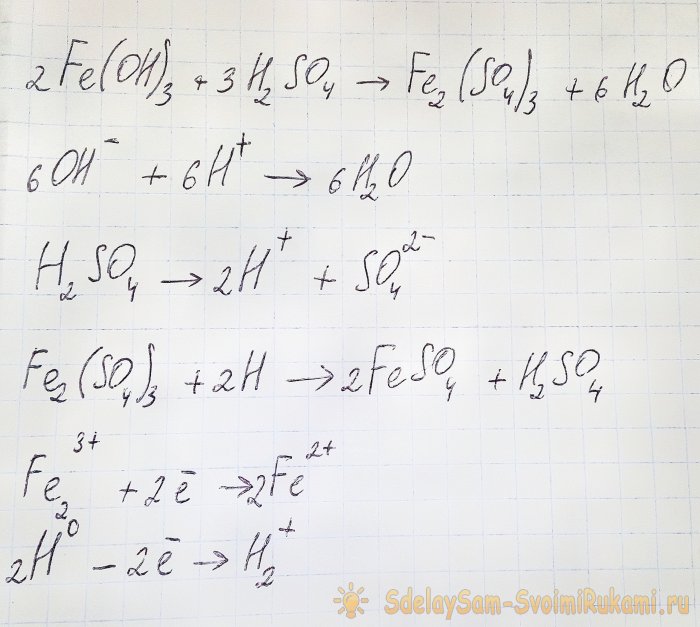Een snelle manier om ferrosulfaat uit kunstmest te verkrijgen
De voorlaatste stap op weg naar het verkrijgen van een edelmetaal uit radiocomponenten is de reductie van dit laatste uit het overeenkomstige chloride. IJzer(II)sulfaat is uitstekend geschikt voor deze doeleinden. Beschouw de vergelijking voor deze reactie:
HAuCl4 - waterstoftetrachloorauraat (III) - een verbinding die wordt gevormd wanneer goud wordt opgelost in koningswater. Op dit proces gaan we voorlopig niet dieper in, omdat het een apart artikel verdient.
Sulfaat (hierna wordt ijzer(II)sulfaat bedoeld) is dus een van de goedkope en gemakkelijk verkrijgbare reductiemiddelen. In de winkels is het te vinden onder de naam “ijzersulfaat”, het is een meststof. Maar dit is geen pure stof, het aandeel sulfaat daarin is ongeveer 50%, de rest zijn onzuiverheden. En voordat we het goud kunnen herstellen, moeten we ons sulfaat zuiveren.
Zal nodig hebben
Hiervoor heb je nodig:
- IJzersulfaat (verkocht in winkels als "alles voor de tuin"; ik kocht een kilo zodat ik genoeg zou hebben voor mijn hoofd);
- Zwavelzuuroplossing, ook bekend als zure elektrolyt voor batterijen (in autodealers);
- Alcohol, ik gebruikte 95%;
- Chemisch of wegwerpservies (bekers, roerlepels).
IJzersulfaat verkrijgen we uit kunstmest
Ik gebruik een glazen pot om de oplossing te bereiden. Binnenin zit 500 ml heet water, misschien iets minder.
Meet nu ongeveer een half glas kunstmest af:
Zoals je kunt zien, is de substantie geelbruin van kleur; dergelijk vuil "sulfaat" kan alleen worden gebruikt voor het beoogde doel: het besproeien van vegetatie. Wij hebben andere doelen.
Giet het in de pot:
De oplossing kreeg een onaangename bruine kleur. De verkleuring ontstond door de reactie van de meststof met water:
IJzer in sulfaat wordt geoxideerd tot driewaardig, en ijzer(III)hydroxide slaat neer, wat feitelijk de reden is voor de kleur ervan.
Om het sulfaat waarin we geïnteresseerd zijn uit de resulterende verbindingen te verkrijgen, is het noodzakelijk om de oplossing aan te zuren met zwavelzuur. Voeg kleine porties toe totdat de oplossing helderder wordt.
In dit geval treden de volgende reacties op:
Het hydroxide reageert met het zuur en vormt ijzer(III)sulfaat (ionenuitwisselingsreactie). Het reageert op zijn beurt met atomair waterstof, dat wordt gevormd tijdens de dissociatie van zwavelzuur. De laatste reactie is redox.
Nu bevat de oplossing precies het sulfaat dat we nodig hebben, maar de oplossing zelf is nog steeds troebel. Laat het zitten en filter het, ik heb een chemisch filter gebruikt.
Onoplosbare onzuiverheden bleven op de bodem van de pot achter:
We spoelen het af en gieten de gefilterde oplossing erin. Het is veel lichter en schoner dan het origineel.
Ethylalcohol verdringt zouten van dibasische zuren uit hun oplossingen. We zullen deze eigenschap gebruiken om vast sulfaat te verkrijgen. We voegen alcohol toe aan de oplossing, ik schonk 200 ml in, wat qua volume gelijk is aan iets meer dan de helft van het oorspronkelijke volume aan kunstmest.
Kristallen van ons sulfaat verschenen onderaan.
Ik liet de oplossing twee dagen staan, zodat al het sulfaat de tijd had om neer te slaan.
Je kunt in eerste instantie meer alcohol toevoegen om dit proces sneller te laten verlopen.
Giet de vloeistof af door op de bodem te tikken en zachtjes te verwarmen, scheid het sulfaat van de pot en giet het op een papieren handdoek om te drogen.
Giet het sulfaat na een paar uur in een glazen pot, etiketteer de stof en in deze vorm kan deze lange tijd worden bewaard.
Omdat kristallijne hydraten neerslaan, is de formule van de stof zoals op de afbeelding. Maar dit weerhoudt ons er niet van om het voor onze eigen doeleinden te gebruiken en het toch in water op te lossen.
Conclusie
Veiligheidsmaatregelen en het naleven van de regels voor het omgaan met zuren zijn een gegeven. We mogen ze in geen geval vergeten.
Schone stoffen voor iedereen!
Soortgelijke masterclasses
Bijzonder interessant
Opmerkingen (1)