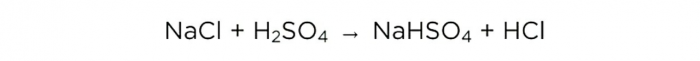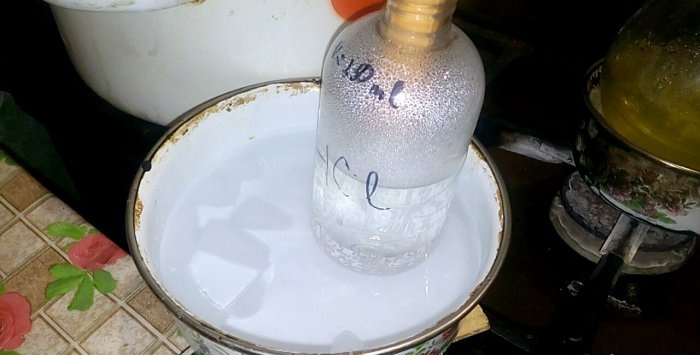Lage saltsyre hjemme
Alkymister som først produserte saltsyre på 1400-tallet kalte den «spiritus salis», «ånd fra salt». På den tiden hadde denne syren magiske egenskaper: den korroderte papir, løste opp metaller og forgiftet mennesker. Disse egenskapene forblir med den til i dag, men nå er denne syren blitt tilstrekkelig studert, og det er ingen magi her.
Saltsyre (HCl) er en sterk monobasisk syre, i sin rene form er det en gjennomsiktig væske. Ved sin maksimale konsentrasjon på 38 % "røyker" den i luften. Vi vil motta syre med en konsentrasjon på det halve.
Så la oss komme i gang.
Sikkerhetstiltak
Vær forsiktig når du arbeider med giftige stoffer!
Alle eksperimenter må utføres i et godt ventilert rom eller under hette Sørg for å bruke vernebriller (kan kjøpes i jernvarehandel) og hansker (hvis du ikke finner spesielle kjemikaliehansker, passer slike av god kvalitet for oppvask).
Natron må være tilstede på stedet for forsøket for å nøytralisere syren i en uforutsett situasjon (dette vil frigjøre karbondioksid og vann).
Det er strengt forbudt å utføre eksperimenter i metallbeholdere.
Vil trenge
For å gjennomføre eksperimentet trenger vi:
- Syreelektrolytt for batterier (selges i en bilbutikk);
- Destillert vann (ibid);
- Bordsalt (tilgjengelig på ethvert kjøkken);
- Natron (se sikkerhetsregler).
Fra oppvasken trenger du:
- Glass kolbe;
- Et kar med sand hvor du kan plassere kolben;
- Flere engangskopper 200 ml;
Hvis du har en varmebestandig kolbe, kan du varme den under åpen flamme i en brenner. Men jeg anbefaler likevel å bruke sand, i så fall vil den absorbere syre.
Du trenger også et par rørleggervinkler med en diameter på 50 mm og en brenner (i mitt tilfelle alkohol, men jeg anbefaler å bruke en gass).
Trinn 1 - fordampning
Elektrolytten for batterier er 36 % svovelsyre (H2SO4). Først må vi øke konsentrasjonen.
Hell 200 ml i glasset, det vil si nesten til randen, og hell litt mer enn halvparten av glasset i kolben. Lag et merke med en tusj og legg til resten.
Jeg plasserte en foliereflektor rundt kolben for mer effektiv oppvarming, men fjernet den senere fordi den begynte å smelte.
Sett nå kolben på brenneren og fordamp til nivået til det tidligere innstilte merket, enda litt lavere.
Samtidig legger vi gasbind foldet flere ganger på hjørnet og fester det med et elastisk bånd. Forbered en umettet brusløsning og dypp enden av hjørnet med gasbind i den.
Når elektrolytten begynner å koke, legger vi et hjørne på kolben, den sitter tett på den. Vi retter gasbindenden inn i det åpne vinduet.
Dette er nødvendig hvis selve svovelsyren plutselig begynner å fordampe sammen med vannet. Hvis du ikke overoppheter kolben for mye, vil dette ikke skje.
Brenner i aksjon:
Brenneren min har relativt lav effekt, så fordampningen tok omtrent en time.En gassbrenner eller elektrisk komfyr ville fremskynde denne prosessen betydelig.
Etter å ha fullført det første trinnet, bør litt mindre enn halvparten av løsningen forbli i kolben, det vil si en syre med en konsentrasjon på omtrent 75%. Ikke glem nøyaktigheten.
La det avkjøles til romtemperatur.
Trinn 2 - beregninger
Nå som vi har konsentrert svovelsyre, kan vi utføre den grunnleggende reaksjonen, den ser slik ut:
Men først, la oss gjøre noen beregninger, og til slutt vil vi sammenligne dem med det som skjedde i praksis.
Så i utgangspunktet hadde vi 200 ml elektrolytt med en tetthet på 1,27 g/cm³. Ser vi på tabellen over tettheter av svovelsyre, ser vi at denne tettheten tilsvarer en konsentrasjon på 36 %. La oss beregne volumet av syre:
200ml*36%=72ml - V(H2SO4)
Etter at vi fordampet løsningen, økte konsentrasjonen, og dermed densiteten. Vi ser på samme tabell og ser at en konsentrasjon på 75 % tilsvarer en tetthet på 1,67 g/cm³.
Når vi kjenner strømtettheten (p) og volumet (V) til syren, finner vi ut massen:
m=p*V;
m(H2SO4) = 1,67 g/cm3 * 72 ml = 120 g;
m(H2SO4) = 1,67 g/cm3 * 72 ml = 120 g;
Nå husker vi fra skolekjemien:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
hvor M er molarmassen til stoffet.
hvor M er molarmassen til stoffet.
De molare massene av H2SO4, NaCl og HCl er henholdsvis 98, 58,5 og 36,5 g/mol. Nå kan vi finne ut hvor mye bordsalt som trengs og hvor mye HCl vi får i oss.
Vi trenger nemlig 72 g NaCl, det er 34 ml, la oss ta det i overkant - et kvart glass.
Flott, og HCl vil i teorien komme ut til 44,7 g.
HCl-tetthetstabellen har en g/l kolonne. Vi tar derfra verdien for en konsentrasjon på 15% - 166,4 g/l. Vannvolumet som kreves for å oppnå 15 % HCl er 44,7/166,4≈270 ml. Vi tar 200 ml. Som et resultat vil jeg i teorien få 22% saltsyre.
Trinn 3 - oppnå syre
Vi kobler de to hjørnene som følger:
Og hele strukturen vil se slik ut:
Den tilsvarende syren vil kondensere til en beholder merket HCl; volumet av vann i den er 200 ml. Merk også gjeldende væskenivå på denne beholderen.
Vi fjerner hjørnene og hell den beregnede mengden salt i kolben gjennom en trakt.
Løsningen blir gul.
For at saltsyre skal begynne å slippe ut, må du slå på brenneren. Men først fester vi hjørnene tett til kolben og mottakerkaret.
Når syre kondenserer i vann, dannes "vertikale bølger". Også oppløsningen varmes opp og må avkjøles. Du kan for eksempel plassere et annet fartøy med is under.
Reaksjonen går relativt raskt - 20 minutter, hvoretter du kan slå av varmen. La de siste dampene av saltsyre løse seg opp i vannet, og forsegl deretter karet hermetisk. Når kolben er avkjølt, fortynn den gjenværende løsningen med vann (omtrent én til én) og hell den i kloakken.
Bunnlinjen
Ved merket på karet bestemmer vi hvor mye væske som er tilsatt. For meg er det ⅙, det vil si 17 %. Dette er konsentrasjonen av saltsyren vår. La oss sammenligne den med den som er oppnådd i teorien.
17%/22%*100%=77% - reaksjonsutbytte.
Det er viktig å merke seg at det ikke er noen utgang lik 1, det er alltid tap. I mitt tilfelle er dette en utilstrekkelig fordampet elektrolytt. Ideelt sett bør konsentrasjonen av svovelsyre være 90-95%.
La oss sjekke den resulterende syren for interaksjon med metall.
Vi observerer rask utvikling av hydrogen. Dette betyr at syren egner seg for videre eksperimenter.
Variasjoner
Du kan bruke en ren glassflaske med øl eller brus som en kolbe, men forutsatt at oppvarmingen er så jevn som mulig. I stedet for PVC-hjørner kan du ta polypropylenrør og hjørner med mindre diameter (egnet for kolben din).
Nok en gang oppfordrer jeg deg til å følge sikkerhetsreglene. Gode opplevelser alle sammen!
Lignende mesterklasser
Spesielt interessant
Kommentarer (19)