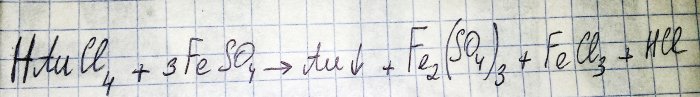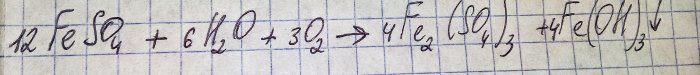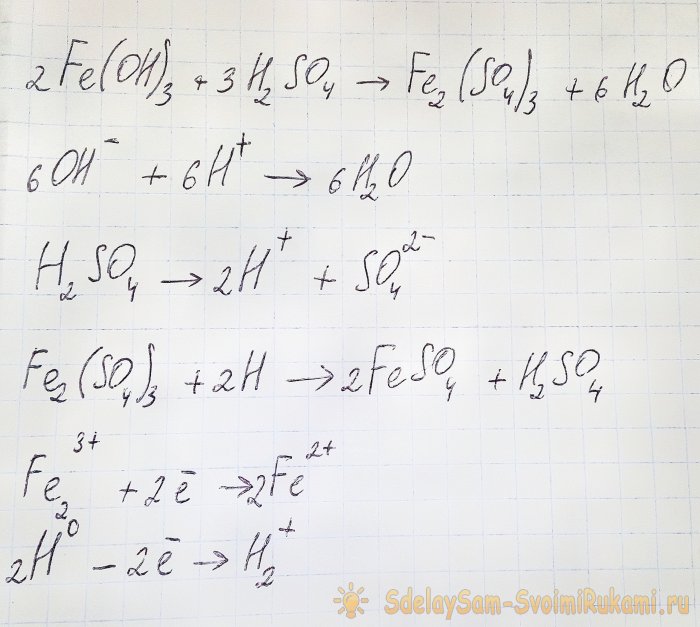En rask måte å få tak i jernsulfat fra gjødsel
Det nest siste trinnet på veien for å oppnå et edelmetall fra radiokomponenter er reduksjonen av sistnevnte fra det tilsvarende kloridet. Jern(II)sulfat er utmerket for disse formålene. Tenk på ligningen for denne reaksjonen:
HAuCl4 - hydrogentetrakloraurat (III) - en forbindelse som dannes når gull løses opp i vannvann. Vi skal ikke gå dypere inn i denne prosessen foreløpig, da den fortjener en egen artikkel.
Så, sulfat (heretter menes jern(II)sulfat) er et av de billige og lett tilgjengelige reduksjonsmidlene. I butikker kan det bli funnet under navnet "jernsulfat", det er en gjødsel. Men dette er ikke et rent stoff, andelen sulfat i det er omtrent 50%, resten er urenheter. Og før vi kan gjenopprette gullet, må vi rense sulfatet vårt.
Vil trenge
For dette trenger du:
- Jernsulfat (selges i butikker som "alt for hagen"; jeg kjøpte en kilo for at jeg skulle ha nok til hodet mitt);
- Svovelsyreløsning, også kjent som syreelektrolytt for batterier (i bilforhandlere);
- Alkohol, jeg brukte 95%;
- Kjemisk eller engangsservise (kopper, røreskjeer).
Vi får jernsulfat fra gjødsel
Jeg bruker en glasskrukke for å forberede løsningen. Inni er det 500 ml varmt vann, kanskje litt mindre.
Mål nå opp omtrent et halvt glass gjødsel:
Som du kan se, er stoffet gulbrun i fargen; slikt skittent "sulfat" kan bare brukes til det tiltenkte formålet - å sprøyte vegetasjon. Vi har andre mål.
Hell det i glasset:
Løsningen fikk en ubehagelig brun farge. Fargingen skjedde på grunn av reaksjonen av gjødsel med vann:
Jern i sulfat oksideres til treverdig, og jern(III)hydroksid utfelles, som faktisk er årsaken til fargen.
For å oppnå sulfatet vi er interessert i fra de resulterende forbindelsene, er det nødvendig å surgjøre løsningen med svovelsyre. Tilsett i små porsjoner til løsningen lysner.
I dette tilfellet oppstår følgende reaksjoner:
Hydroksydet reagerer med syren og danner jern(III)sulfat (ionebytterreaksjon). Det reagerer igjen med atomært hydrogen, som dannes under dissosiasjonen av svovelsyre. Den siste reaksjonen er redoks.
Nå inneholder løsningen akkurat det sulfatet vi trenger, men selve løsningen er fortsatt uklar. La det sitte og filtrere det, jeg brukte et kjemisk filter.
Uløselige urenheter forble i bunnen av glasset:
Vi skyller den og hell den filtrerte løsningen i den. Den er mye lettere og renere enn originalen.
Etylalkohol fortrenger salter av dibasiske syrer fra løsningene deres. Vi vil bruke denne egenskapen for å oppnå fast sulfat. Vi tilsetter alkohol til løsningen, jeg helte 200 ml, som er lik i volum til litt mer enn halvparten av det opprinnelige volumet av gjødsel.
Krystaller av sulfatet vårt dukket opp på bunnen.
Jeg lot løsningen stå i to dager slik at alt sulfatet rakk å felle ut.
Du kan først tilsette mer alkohol for å gjøre denne prosessen raskere.
Tøm væsken ved å banke på bunnen og forsiktig oppvarming, separer sulfatet fra glasset og hell det på et papirhåndkle for å tørke.
Etter noen timer, hell sulfatet i en glasskrukke, merk stoffet, og i denne formen kan det lagres i lang tid.
Siden krystallinske hydrater utfelte, er formelen til stoffet som på bildet. Men dette hindrer oss ikke i å bruke det til egne formål, uansett å løse det opp i vann.
Konklusjon
Sikkerhetstiltak og overholdelse av reglene for håndtering av syrer er gitt. Under ingen omstendigheter bør vi glemme dem.
Rene stoffer til alle!
Lignende mesterklasser
Spesielt interessant
Kommentarer (1)