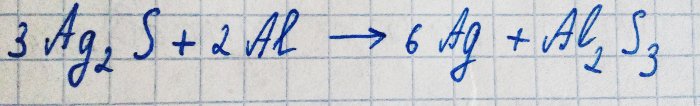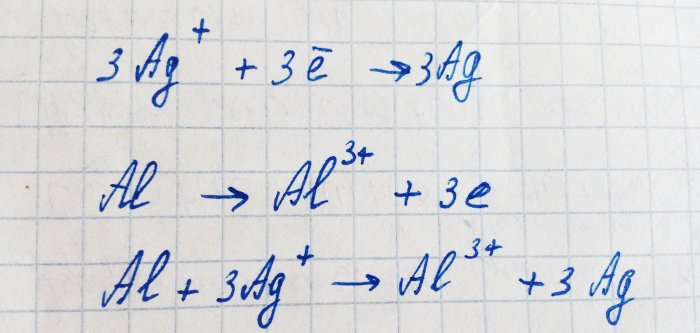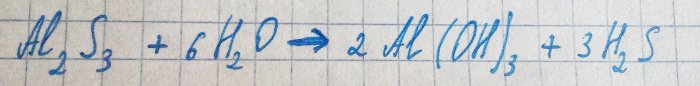Limpando itens de prata em casa
Recentemente encontrei um conjunto de talheres de prata com cerca de cem anos. Durante esse tempo, as colheres e facas conseguiram escurecer e enferrujar, e resolvi limpá-las dos depósitos que se formaram. Neste artigo, compartilharei uma maneira bastante eficaz de restaurar o brilho original de seus talheres antigos. Então vamos.
Teoria
Primeiro, vamos descobrir por que a prata escurece com o tempo e de onde vem a ferrugem.
A prata (Ag) praticamente não apresenta reatividade com oxigênio ou água, ou seja, não enferruja. Esta propriedade foi notada pela primeira vez pelos alquimistas, que começaram a chamar a prata de metal nobre.
No entanto, a prata reage com o sulfeto de hidrogênio na presença de oxigênio. A equação para esta reação é a seguinte:
O sulfeto de prata resultante apenas cobre o metal com uma película escura, evitando maior oxidação.
Se os talheres não forem feitos de prata pura (por exemplo, padrão 800), as impurezas da liga enferrujam.
Remoção de ferrugem
Prepare uma solução de ácido cítrico. Quanto mais saturado estiver, mais rápida e violenta será a reação.Colocamos talheres nele, quando as bolhas de gás param de sair, tiramos da solução, enxáguamos com água e enxugamos com papel toalha.
Para melhores resultados, você pode aquecer a solução a 80°C, mas é importante seguir as precauções de segurança.
Remoção de placa
Para remover a placa bacteriana, usaremos o método químico de redução do sulfeto de prata em metal livre.
Para isso precisamos:
- - o recipiente onde ocorrerá a reação;
- - bicarbonato de sódio;
- - folha de alumínio;
- - sal de mesa;
- - água quente.
Coloque papel alumínio no fundo do recipiente e objetos prateados em cima, com o lado escuro voltado para baixo.
Polvilhe refrigerante por cima.
Agora dissolva o sal em água na proporção de 6 colheres de sopa por litro de água. Despeje a solução resultante no recipiente, a reação começa com a liberação de sulfeto de hidrogênio e dióxido de carbono.
Todo o processo deve ser realizado ao ar livre, pois o sulfeto de hidrogênio tem cheiro característico de ovo podre e é prejudicial à saúde.
Vejamos a química do que está acontecendo.
Primeiro, o refrigerante dissolve a fina película de hidróxido da superfície da folha.
Isto dá ao sulfeto de prata a oportunidade de reagir diretamente com o alumínio.
O alumínio tem uma energia de ionização menor que a prata. Ele se oxida em um íon, dando à prata seus elétrons. Este processo pode ser escrito assim:
Essa reação é eletroquímica: devido ao movimento dos elétrons do alumínio para a prata, surge uma diferença de potencial.
O sal em uma solução melhora sua condutividade, permitindo que a reação prossiga até o fim.
O sulfeto de alumínio liberado reage imediatamente com a água:
Daí o sulfeto de hidrogênio e o cheiro correspondente.
Esse processo pode levar até meia hora. Ao terminar, enxágue os talheres com água e seque com uma toalha.
Após a restauração da prata, você pode usar meios especiais para preservá-la. Eles protegem a superfície prateada da umidade e do sulfeto de hidrogênio.
Dessa forma, a prata manterá o brilho por muito tempo.
Conclusão
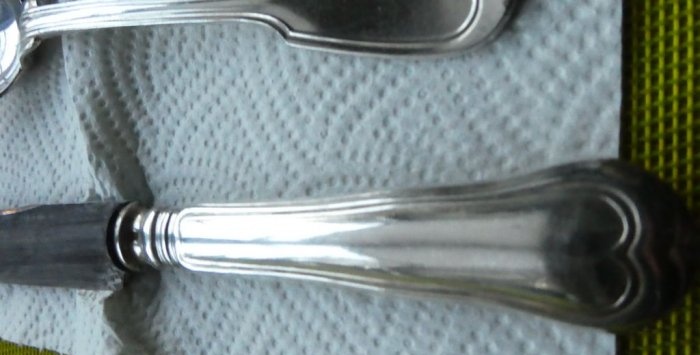
Fotos de pratos restaurados:
Como você pode ver, não há vestígios de escurecimento nas colheres. As facas também começaram a ficar melhores, porém, infelizmente, parte da camada prateada desapareceu de sua superfície; o tempo ainda cobra seu preço. Você terá que levá-los a um especialista para prateá-los novamente.
E este artigo chegou ao fim. Boa sorte com sua repetição a todos!
Artigo original em inglês
Master classes semelhantes
Particularmente interessante
Comentários (0)