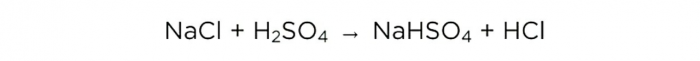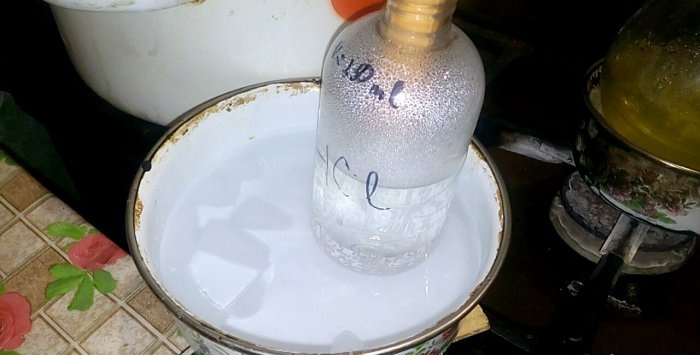Producerea acidului clorhidric acasă
Alchimiștii care au produs pentru prima dată acid clorhidric în secolul al XV-lea l-au numit „spiritus salis”, „spirit din sare”. La acea vreme, acest acid avea proprietăți magice: coroda hârtia, dizolva metalele și otrăvea oamenii. Aceste proprietăți rămân cu el până astăzi, dar acum acest acid a fost suficient studiat și nu există nicio magie aici.
Acidul clorhidric (HCl) este un acid monobazic puternic, în forma sa pură este un lichid transparent. La concentrația sa maximă de 38% „fumă” în aer. Vom primi acid cu o concentrație de jumătate.
Asadar, haideti sa începem.
Măsuri de siguranță
Aveți grijă când lucrați cu substanțe toxice!
Toate experimentele trebuie efectuate într-o încăpere bine ventilată sau sub hotă.Asigurați-vă că purtați ochelari de protecție (pot fi achiziționați de la un magazin de hardware) și mănuși (dacă nu găsiți mănuși speciale chimice, sunt potrivite cele de bună calitate). pentru spălarea vaselor).
Bicarbonatul de sodiu trebuie să fie prezent la locul experimentului pentru a neutraliza acidul într-o situație neprevăzută (acest lucru va elibera dioxid de carbon și apă).
Este strict interzisă efectuarea de experimente în recipiente metalice.
Va avea nevoie
Pentru a efectua experimentul vom avea nevoie de:
- Electrolit acid pentru baterii (vândut într-un magazin auto);
- Apă distilată (ibid);
- Sare de masă (disponibilă în orice bucătărie);
- Bicarbonat de sodiu (vezi măsuri de siguranță).
Din preparatele de care ai nevoie:
- Balon de sticlă;
- Un vas cu nisip unde se poate așeza balonul;
- Mai multe pahare de unica folosinta 200 ml;
Dacă aveți un balon rezistent la căldură, îl puteți încălzi sub flacăra deschisă a unui arzător. Dar tot recomand să folosești nisip, caz în care va absorbi acidul.
Veți avea nevoie și de o pereche de colțuri de instalație cu diametrul de 50 mm și de un arzător (în cazul meu, alcool, dar vă recomand să folosiți unul pe gaz).
Etapa 1 - evaporare
Electrolitul pentru baterii este 36% acid sulfuric (H2SO4). Mai întâi trebuie să creștem concentrația acestuia.
Se toarnă 200 ml în pahar, adică aproape până la refuz, și se toarnă puțin mai mult de jumătate din pahar în balon. Faceți un semn cu un marker și adăugați restul.
Am așezat un reflector de folie în jurul balonului pentru o încălzire mai eficientă, dar ulterior l-am îndepărtat pentru că a început să se topească.
Acum puneți balonul pe arzător și evaporați până la nivelul semnului setat anterior, chiar puțin mai jos.
În același timp, punem tifon îndoit de mai multe ori pe colț și îl fixăm cu o bandă elastică. Pregătiți o soluție de sifon nesaturat și înmuiați capătul colțului cu tifon în ea.
Când electrolitul începe să fiarbă, punem un colț pe balon, se așează bine pe el. Îndreptăm capătul de tifon în fereastra deschisă.
Acest lucru este necesar dacă brusc acidul sulfuric însuși începe să se evapore împreună cu apa. Dacă nu supraîncălziți balonul prea mult, acest lucru nu se va întâmpla.
Arzatorul in actiune:
Arzătorul meu are o putere relativ mică, așa că evaporarea a durat aproximativ o oră.Un arzător cu gaz sau aragaz electric ar accelera acest proces în mod semnificativ.
După finalizarea primei etape, puțin mai puțin de jumătate din soluție ar trebui să rămână în balon, adică un acid cu o concentrație de aproximativ 75%. Nu uitați de acuratețe.
Se lasa sa se raceasca la temperatura camerei.
Etapa 2 - calcule
Acum că avem acid sulfuric concentrat, putem efectua reacția de bază, arată astfel:
Dar mai întâi, să facem niște calcule, iar la final le vom compara cu ceea ce s-a întâmplat în practică.
Deci, inițial am avut 200 ml de electrolit cu o densitate de 1,27 g/cm³. Privind tabelul cu densitățile acidului sulfuric, vedem că această densitate corespunde unei concentrații de 36%. Să calculăm volumul de acid:
200ml*36%=72ml - V(H2SO4)
După ce am evaporat soluția, a crescut concentrația și, prin urmare, densitatea. Ne uităm la același tabel și vedem că o concentrație de 75% corespunde unei densități de 1,67 g/cm³.
Cunoscând densitatea de curent (p) și volumul (V) acidului, aflăm masa:
m=p*V;
m(H2S04)=1,67g/cm³ * 72ml=120g;
m(H2S04)=1,67g/cm³ * 72ml=120g;
Acum ne amintim de la chimia școlii:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCI)/M(HCI),
unde M este masa molară a substanței.
unde M este masa molară a substanței.
Masele molare de H2SO4, NaCl și HCl sunt de 98, 58,5 și, respectiv, 36,5 g/mol. Acum putem afla de câtă sare de masă este necesară și cât de mult HCl vom obține.
Și anume, avem nevoie de 72 g de NaCl, adică 34 ml, să-l luăm în exces - un sfert de pahar.
Grozav, iar HCl în teorie va ajunge la 44,7 g.
Tabelul cu densitatea HCl are o coloană g/l. Preluăm de acolo valoarea pentru o concentrație de 15% - 166,4 g/l. Volumul de apă necesar pentru a obține 15% HCI este de 44,7/166,4≈270ml. Vom lua 200 ml. Ca rezultat, teoretic, voi obține acid clorhidric 22%.
Etapa 3 - obținerea acidului
Conectăm cele două colțuri după cum urmează:
Și întreaga structură va arăta astfel:
Acidul corespunzător se va condensa într-un vas marcat cu HCl; volumul de apă din el este de 200 ml. De asemenea, marcați nivelul curent al lichidului pe acest recipient.
Îndepărtăm colțurile și turnăm cantitatea calculată de sare în balon printr-o pâlnie.
Soluția devine galbenă.
Pentru ca acidul clorhidric să înceapă să se elibereze, trebuie să porniți arzătorul. Dar mai întâi, atașăm strâns colțurile de balon și de vasul de primire.
Când acidul se condensează în apă, se formează „valuri verticale”. De asemenea, soluția se încălzește și trebuie răcită. De exemplu, puteți plasa un alt vas cu gheață dedesubt.
Reacția are loc relativ rapid - 20 de minute, după care puteți opri focul. Lăsați ultimii vapori de acid clorhidric să se dizolve în apă și apoi etanșați vasul ermetic. Când balonul s-a răcit, diluați soluția rămasă cu apă (aproximativ unu la unu) și turnați-o în canalizare.
Concluzie
După semnul de pe vas determinăm cât de mult lichid a fost adăugat. Pentru mine este ⅙, adică 17%. Aceasta este concentrația acidului nostru clorhidric. Să-l comparăm cu cel obținut în teorie.
17%/22%*100%=77% - randament de reacție.
Este important de reținut că nu există o ieșire egală cu 1, există întotdeauna pierderi. În cazul meu, acesta este un electrolit insuficient evaporat. În mod ideal, concentrația de acid sulfuric ar trebui să fie de 90-95%.
Să verificăm acidul rezultat pentru interacțiunea cu metalul.
Observăm o evoluție rapidă a hidrogenului. Aceasta înseamnă că acidul este potrivit pentru experimente ulterioare.
Variante
Puteți folosi o sticlă curată de bere sau sifon ca balon, dar cu condiția ca încălzirea să fie cât mai lină. În loc de colțuri din PVC, puteți lua țevi din polipropilenă și colțuri cu un diametru mai mic (potrivite pentru balonul dvs.).
Vă îndemn încă o dată să respectați măsurile de siguranță. Experiențe fericite tuturor!
Cursuri de master similare
Deosebit de interesant
Comentarii (19)