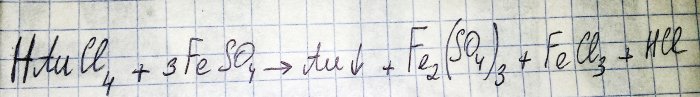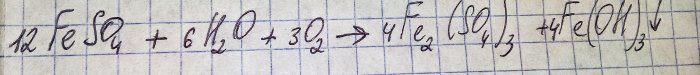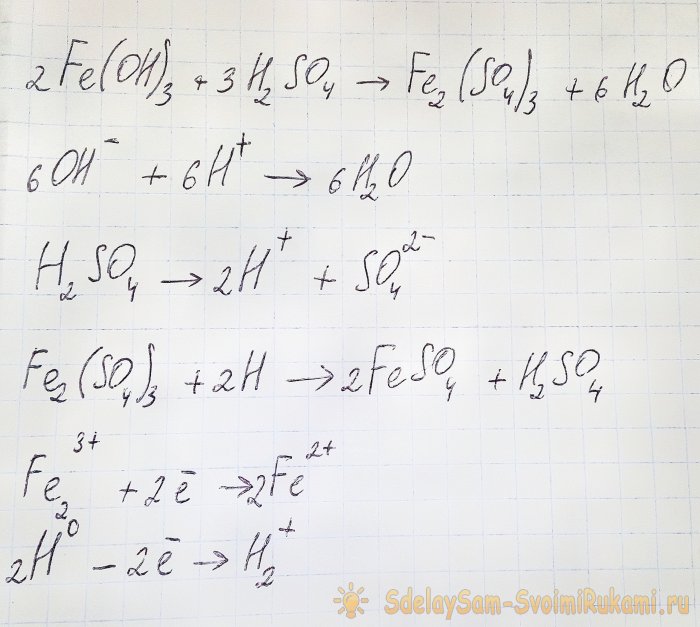O modalitate rapidă de a obține sulfat feros din îngrășământ
Penultimul pas pe calea obținerii unui metal nobil din componente radio este reducerea acestuia din urmă din clorura corespunzătoare. Sulfatul de fier (II) este excelent în aceste scopuri. Luați în considerare ecuația pentru această reacție:
HAuCl4 - tetracloroaurat de hidrogen (III) - un compus care se formează atunci când aurul este dizolvat în acva regia. Nu vom aprofunda acest proces deocamdată, deoarece merită un articol separat.
Deci, sulfatul (denumit în continuare sulfatul de fier (II) se înțelege) este unul dintre agenții reducători ieftini și ușor disponibili. În magazine poate fi găsit sub denumirea de „sulfat de fier”, este un îngrășământ. Dar aceasta nu este o substanță pură, proporția de sulfat din ea este de aproximativ 50%, restul sunt impurități. Și înainte de a putea restabili aurul, trebuie să ne purificăm sulfatul.
Va avea nevoie
Pentru aceasta vei avea nevoie de:
- Sulfat de fier (se vinde in magazine gen „totul pentru gradina”; mi-am cumparat un kilogram ca sa-mi ajung la cap);
- Soluție de acid sulfuric, cunoscută și sub denumirea de electrolit acid pentru baterii (în reprezentanțele auto);
- Alcool, am folosit 95%;
- Veselă chimică sau de unică folosință (cești, linguri pentru amestecare).
Obținem sulfat de fier din îngrășământ
Folosesc un borcan de sticlă pentru a pregăti soluția. Înăuntru sunt 500 ml apă fierbinte, poate puțin mai puțin.
Acum măsurați aproximativ jumătate de pahar de îngrășământ:
După cum puteți vedea, substanța este de culoare galben-maro; un astfel de „sulfat” murdar poate fi folosit numai în scopul propus - pentru a pulveriza vegetația. Avem alte obiective.
Se toarnă în borcan:
Soluția a căpătat o culoare maro neplăcută. Colorarea a apărut datorită reacției îngrășământului cu apa:
Fierul din sulfat este oxidat la trivalent, iar hidroxidul de fier (III) precipită, ceea ce este de fapt motivul culorii sale.
Pentru a obține sulfatul care ne interesează din compușii rezultați este necesară acidificarea soluției cu acid sulfuric. Adăugați în porții mici până când soluția se luminează.
În acest caz, apar următoarele reacții:
Hidroxidul reacționează cu acidul pentru a forma sulfat de fier (III) (reacție de schimb ionic). La rândul său, reacţionează cu hidrogenul atomic, care se formează în timpul disocierii acidului sulfuric. Ultima reacție este redox.
Acum soluția conține exact sulfatul de care avem nevoie, dar soluția în sine este încă tulbure. Lasă-l să stea și filtrează, eu am folosit un filtru chimic.
Impuritățile insolubile au rămas în fundul borcanului:
Îl clătim și turnăm soluția filtrată în el. Este mult mai ușor și mai curat decât originalul.
Alcoolul etilic înlocuiește sărurile acizilor dibazici din soluțiile acestora. Vom folosi această proprietate pentru a obține sulfat solid. Adăugăm alcool în soluție, am turnat 200 ml, care este egal ca volum cu puțin mai mult de jumătate din volumul inițial de îngrășământ.
Cristalele sulfatului nostru au apărut în partea de jos.
Am lăsat soluția două zile pentru ca tot sulfatul să aibă timp să precipite.
Puteți adăuga inițial mai mult alcool pentru a face acest proces mai rapid.
Scurgeți lichidul, apăsând pe fund și încălzind ușor, separați sulfatul din borcan și turnați-l pe un prosop de hârtie pentru a se usuca.
După câteva ore, turnați sulfatul într-un borcan de sticlă, etichetați substanța și, în această formă, poate fi păstrat mult timp.
Deoarece hidrații cristalini au precipitat, formula substanței este ca în imagine. Dar acest lucru nu ne împiedică să-l folosim în scopuri proprii, dizolvându-l oricum în apă.
Concluzie
Măsurile de siguranță și respectarea regulilor de manipulare a acizilor sunt date. În niciun caz nu trebuie să uităm de ele.
Substanțe curate pentru toată lumea!
Cursuri de master similare
Deosebit de interesant
Comentarii (1)