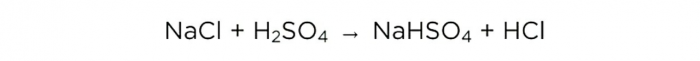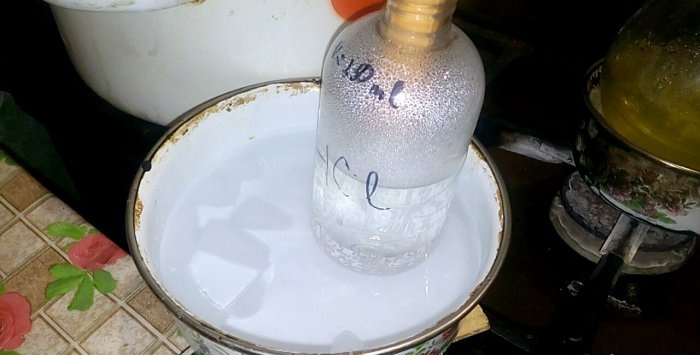Výroba kyseliny chlorovodíkovej doma
Alchymisti, ktorí prvýkrát vyrobili kyselinu chlorovodíkovú v 15. storočí, ju nazývali „spiritus salis“, „duch zo soli“. V tom čase mala táto kyselina magické vlastnosti: korodovala papier, rozpúšťala kovy a otravovala ľudí. Tieto vlastnosti mu zostávajú dodnes, ale teraz je táto kyselina dostatočne preštudovaná a nie je tu žiadna mágia.
Kyselina chlorovodíková (HCl) je silná jednosýtna kyselina, v čistej forme je to priehľadná kvapalina. Pri maximálnej koncentrácii 38% „dymí“ vo vzduchu. Kyselinu dostaneme s polovičnou koncentráciou.
Tak poďme na to.
Bezpečnostné opatrenia
Buďte opatrní pri práci s toxickými látkami!
Všetky pokusy sa musia vykonávať v dobre vetranej miestnosti alebo pod digestorom.Uistite sa, že noste ochranné okuliare (možno zakúpiť v železiarstve) a rukavice (ak nenájdete špeciálne chemické rukavice, vhodné sú kvalitné na umývanie riadu).
Na mieste pokusu musí byť prítomná sóda bikarbóna, aby sa kyselina v nepredvídanej situácii neutralizovala (uvoľní sa tým oxid uhličitý a voda).
Je prísne zakázané vykonávať experimenty v kovových nádobách.
Bude potrebovať
Na vykonanie experimentu budeme potrebovať:
- Kyslý elektrolyt pre batérie (predávaný v obchode s automobilmi);
- Destilovaná voda (ibid);
- Stolová soľ (dostupná v každej kuchyni);
- Jedlá sóda (pozri bezpečnostné opatrenia).
Z jedál, ktoré potrebujete:
- Sklenená banka;
- Nádoba s pieskom, kde môžete umiestniť banku;
- Niekoľko jednorazových pohárov 200 ml;
Ak máte žiaruvzdornú banku, môžete ju zohrievať pod otvoreným plameňom horáka. Ale aj tak odporúčam použiť piesok, v takom prípade bude absorbovať kyselinu.
Ďalej budete potrebovať pár klampiarskych uholníkov s priemerom 50mm a horák (v mojom prípade liehový, ale odporúčam použiť plynový).
1. fáza - odparovanie
Elektrolytom pre batérie je 36% kyselina sírová (H2SO4). Najprv musíme zvýšiť jeho koncentráciu.
Do pohára nalejte 200 ml, teda takmer po okraj, a do banky nalejte o niečo viac ako polovicu pohára. Urobte značku fixou a pridajte zvyšok.
Okolo banky som umiestnil fóliový reflektor kvôli efektívnejšiemu ohrevu, no neskôr som ho odstránil, pretože sa začal topiť.
Teraz položte banku na horák a odparte na úroveň predtým nastavenej značky, dokonca o niečo nižšie.
Zároveň na roh položíme niekoľkokrát preloženú gázu a zaistíme gumičkou. Pripravte si nenasýtený roztok sódy a ponorte do neho koniec rohu s gázou.
Keď elektrolyt začne vrieť, položíme roh na banku, pevne na nej sedí. Koniec gázy smerujeme do otvoreného okna.
To je potrebné, ak sa zrazu začne odparovať samotná kyselina sírová spolu s vodou. Ak banku príliš neprehrejete, nestane sa to.
Horák v akcii:
Môj horák má relatívne nízky príkon, takže odparovanie trvalo asi hodinu.Plynový horák alebo elektrický sporák by tento proces výrazne urýchlili.
Po dokončení prvého stupňa by malo v banke zostať o niečo menej ako polovica roztoku, to znamená kyselina s koncentráciou asi 75%. Nezabudnite na presnosť.
Necháme vychladnúť na izbovú teplotu.
2. fáza - výpočty
Teraz, keď máme koncentrovanú kyselinu sírovú, môžeme vykonať základnú reakciu, ktorá vyzerá takto:
Najprv si však urobme výpočty a na záver ich porovnáme s tým, čo sa stalo v praxi.
Na začiatku sme teda mali 200 ml elektrolytu s hustotou 1,27 g/cm³. Pri pohľade na tabuľku hustôt kyseliny sírovej vidíme, že táto hustota zodpovedá koncentrácii 36 %. Vypočítajme objem kyseliny:
200 ml x 36 % = 72 ml - V (H2SO4)
Potom, čo sme roztok odparili, jeho koncentrácia a tým aj hustota vzrástla. Pozeráme sa na rovnakú tabuľku a vidíme, že koncentrácia 75 % zodpovedá hustote 1,67 g/cm³.
Keď poznáme prúdovú hustotu (p) a objem (V) kyseliny, zistíme hmotnosť:
m=p*V;
m(H2S04) = 1,67 g/cm3 * 72 ml = 120 g;
m(H2S04) = 1,67 g/cm3 * 72 ml = 120 g;
Teraz si pamätáme zo školskej chémie:
m(H2S04)/M(H2S04)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
kde M je molárna hmotnosť látky.
kde M je molárna hmotnosť látky.
Molové hmotnosti H2SO4, NaCl a HCl sú 98, 58,5 a 36,5 g/mol, v tomto poradí. Teraz môžeme zistiť, koľko kuchynskej soli treba a koľko HCl získame.
Totiž potrebujeme 72 g NaCl, to je 34 ml, vezmime nadbytok - štvrť pohára.
Super a HCl teoreticky vyjde na 44,7 g.
Tabuľka hustoty HCl má stĺpec g/l. Odtiaľ berieme hodnotu pre koncentráciu 15% - 166,4 g/l. Objem vody potrebný na získanie 15 % HCl je 44,7/166,4≈270 ml. Odoberieme 200 ml. V dôsledku toho teoreticky získam 22% kyselinu chlorovodíkovú.
3. fáza - získanie kys
Oba rohy spojíme takto:
A celá štruktúra bude vyzerať takto:
Zodpovedajúca kyselina bude kondenzovať v nádobe označenej HCl, objem vody v nej je 200 ml. Na tejto nádobe si tiež označte aktuálnu hladinu kvapaliny.
Odstránime rohy a vypočítané množstvo soli nasypeme do banky cez lievik.
Roztok zožltne.
Aby sa kyselina chlorovodíková začala uvoľňovať, musíte zapnúť horák. Najprv však pevne pripevníme rohy k banke a prijímacej nádobe.
Keď kyselina kondenzuje vo vode, vytvárajú sa „vertikálne vlny“. Roztok sa tiež zahrieva a musí sa ochladiť. Dole môžete napríklad umiestniť ďalšiu nádobu s ľadom.
Reakcia prebieha pomerne rýchlo - 20 minút, po ktorých môžete teplo vypnúť. Nechajte vo vode rozpustiť posledné výpary kyseliny chlorovodíkovej a potom nádobu hermeticky uzavrite. Keď banka vychladne, zrieďte zvyšný roztok vodou (približne jedna ku jednej) a vylejte do kanalizácie.
Spodná čiara
Podľa značky na nádobe určíme, koľko tekutiny sa pridalo. U mňa je to ⅙, teda 17 %. Toto je koncentrácia našej kyseliny chlorovodíkovej. Porovnajme to s tým získaným teoreticky.
17 %/22 % x 100 % = 77 % - výťažok reakcie.
Je dôležité poznamenať, že neexistuje žiadny výstup rovný 1, vždy sú straty. V mojom prípade ide o nedostatočne odparený elektrolyt. V ideálnom prípade by koncentrácia kyseliny sírovej mala byť 90-95%.
Skontrolujme výslednú kyselinu na interakciu s kovom.
Pozorujeme rýchly vývoj vodíka. To znamená, že kyselina je vhodná na ďalšie experimenty.
Variácie
Ako banku môžete použiť čistú sklenenú fľašu od piva alebo sódy, ale za predpokladu, že ohrev bude čo najhladší. Namiesto PVC rohov si môžete vziať polypropylénové rúry a rohy menšieho priemeru (vhodné pre vašu banku).
Ešte raz vás žiadam, aby ste dodržiavali bezpečnostné opatrenia. Šťastné zážitky všetkým!
Podobné majstrovské kurzy
Obzvlášť zaujímavé
Komentáre (19)