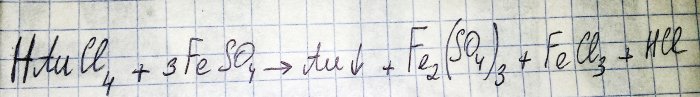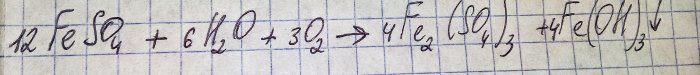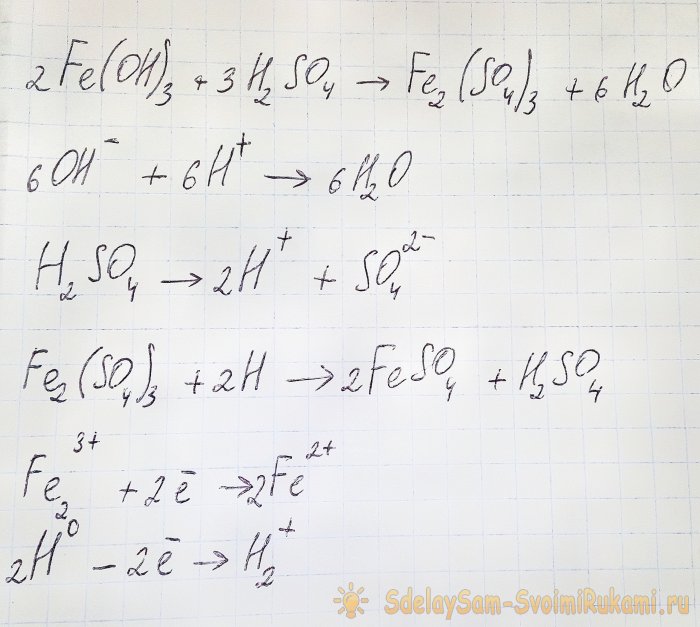Ett snabbt sätt att få järnsulfat från gödningsmedel
Det näst sista steget på vägen för att erhålla en ädelmetall från radiokomponenter är reduktionen av den senare från motsvarande klorid. Järn(II)sulfat är utmärkt för dessa ändamål. Tänk på ekvationen för denna reaktion:
HAuCl4 - vätetrakloraurat (III) - en förening som bildas när guld löses i aqua regia. Vi kommer inte att gå djupare in på denna process för nu, eftersom den förtjänar en separat artikel.
Så, sulfat (nedan avses järn(II)sulfat) är ett av de billiga och lättillgängliga reduktionsmedlen. I butiker kan det hittas under namnet "järnsulfat", det är ett gödningsmedel. Men detta är inte ett rent ämne, andelen sulfat i det är cirka 50%, resten är föroreningar. Och innan vi kan återställa guldet måste vi rena vårt sulfat.
Kommer att behöva
För detta behöver du:
- Järnsulfat (säljs i butiker som "allt för trädgården"; jag köpte ett kilo för att jag skulle ha tillräckligt för mitt huvud);
- Svavelsyralösning, även känd som sur elektrolyt för batterier (i bilhandlare);
- Alkohol, jag använde 95%;
- Kemisk eller engångsservis (koppar, omrörningsskedar).
Vi får järnsulfat från gödningsmedel
Jag använder en glasburk för att förbereda lösningen. Inuti finns det 500 ml varmvatten, kanske lite mindre.
Mät nu upp ett halvt glas gödselmedel:
Som du kan se är ämnet gulbrun till färgen; sådant smutsigt "sulfat" kan bara användas för det avsedda syftet - för att spraya vegetation. Vi har andra mål.
Häll det i burken:
Lösningen fick en obehaglig brun färg. Färgningen uppstod på grund av gödselmedlets reaktion med vatten:
Järn i sulfat oxideras till trevärt och järn(III)hydroxid faller ut, vilket faktiskt är orsaken till dess färg.
För att få det sulfat som vi är intresserade av från de resulterande föreningarna är det nödvändigt att surgöra lösningen med svavelsyra. Tillsätt i små portioner tills lösningen ljusnar.
I det här fallet inträffar följande reaktioner:
Hydroxiden reagerar med syran och bildar järn(III)sulfat (jonbytarreaktion). Det reagerar i sin tur med atomärt väte, som bildas under dissociationen av svavelsyra. Den sista reaktionen är redox.
Nu innehåller lösningen exakt det sulfat vi behöver, men själva lösningen är fortfarande grumlig. Låt det sitta och filtrera det, jag använde ett kemiskt filter.
Olösliga föroreningar fanns kvar på botten av burken:
Vi sköljer den och häller den filtrerade lösningen i den. Det är mycket lättare och renare än originalet.
Etylalkohol ersätter salter av tvåbasiska syror från deras lösningar. Vi kommer att använda den här egenskapen för att få fast sulfat. Vi tillsätter alkohol till lösningen, jag hällde 200 ml, vilket är lika i volym till lite mer än hälften av den ursprungliga volymen gödselmedel.
Kristaller av vårt sulfat dök upp längst ner.
Jag lämnade lösningen i två dagar så att allt sulfat hann fällas ut.
Du kan till en början lägga till mer alkohol för att göra processen snabbare.
Töm vätskan genom att knacka på botten och försiktig uppvärmning, separera sulfatet från burken och häll det på en pappershandduk för att torka.
Efter några timmar, häll sulfatet i en glasburk, märk ämnet, och i denna form kan det lagras under lång tid.
Eftersom kristallina hydrater fälldes ut är formeln för ämnet som på bilden. Men detta hindrar oss inte från att använda det för våra egna syften, lösa det i vatten ändå.
Slutsats
Säkerhetsföreskrifter och efterlevnad av reglerna för hantering av syror är givet. Vi får under inga omständigheter glömma dem.
Rena ämnen till alla!
Liknande mästarklasser
Särskilt intressant
Kommentarer (1)