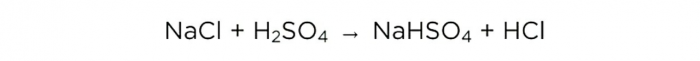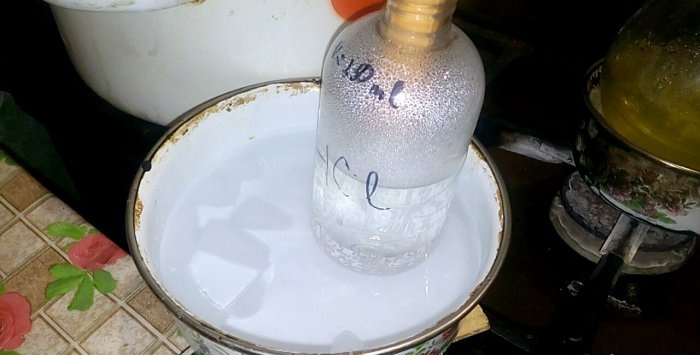การทำกรดไฮโดรคลอริกที่บ้าน
นักเล่นแร่แปรธาตุที่ผลิตกรดไฮโดรคลอริกครั้งแรกในศตวรรษที่ 15 เรียกมันว่า "spiritus salis" "วิญญาณจากเกลือ" ในเวลานั้น กรดนี้มีคุณสมบัติวิเศษ คือ กัดกร่อนกระดาษ โลหะที่ละลาย และเป็นพิษต่อผู้คน คุณสมบัติเหล่านี้ยังคงอยู่มาจนถึงทุกวันนี้ แต่ตอนนี้กรดนี้ได้รับการศึกษาอย่างเพียงพอแล้ว และไม่มีเวทย์มนตร์ที่นี่
กรดไฮโดรคลอริก (HCl) เป็นกรด monobasic ที่แข็งแกร่ง ในรูปแบบบริสุทธิ์จะเป็นของเหลวใส ที่ความเข้มข้นสูงสุด 38% มันจะ "ควัน" ในอากาศ เราจะได้กรดที่มีความเข้มข้นเพียงครึ่งหนึ่งนั้น
มาเริ่มกันเลย
ข้อควรระวังด้านความปลอดภัย
ระวังเมื่อทำงานกับสารพิษ!
การทดลองทั้งหมดจะต้องดำเนินการในห้องที่มีการระบายอากาศดีหรือใต้ฝาครอบ อย่าลืมสวมแว่นตานิรภัย (หาซื้อได้ตามร้านฮาร์ดแวร์) และถุงมือ (หากหาถุงมือเคมีชนิดพิเศษไม่ได้ ก็ควรใช้ถุงมือคุณภาพดี สำหรับล้างจาน)
ต้องมีเบกกิ้งโซดาอยู่ที่บริเวณที่ทำการทดลองเพื่อทำให้กรดเป็นกลางในสถานการณ์ที่ไม่คาดฝัน (ซึ่งจะปล่อยก๊าซคาร์บอนไดออกไซด์และน้ำ)
ห้ามทำการทดลองในภาชนะโลหะโดยเด็ดขาด
จะต้อง
ในการทำการทดลองเราจะต้อง:
- อิเล็กโทรไลต์กรดสำหรับแบตเตอรี่ (ขายในร้านขายรถยนต์)
- น้ำกลั่น (อ้างแล้ว);
- เกลือแกง (มีในครัวทุกชนิด);
- เบกกิ้งโซดา (ดูข้อควรระวังเพื่อความปลอดภัย)
จากจานที่คุณต้องการ:
- ขวดแก้ว
- ภาชนะที่มีทรายสำหรับวางขวด
- ถ้วยใช้แล้วทิ้งหลายใบ 200 มล.
หากคุณมีขวดทนความร้อน คุณสามารถให้ความร้อนโดยใช้เปลวไฟจากหัวเตาได้ แต่ฉันก็ยังแนะนำให้ใช้ทราย ในกรณีนี้ทรายจะดูดซับกรด
คุณจะต้องมีมุมประปาคู่หนึ่งที่มีเส้นผ่านศูนย์กลาง 50 มม. และหัวเผา (ในกรณีของฉันคือแอลกอฮอล์ แต่ฉันแนะนำให้ใช้แก๊ส)
ด่าน 1 - การระเหย
อิเล็กโทรไลต์สำหรับแบตเตอรี่คือกรดซัลฟิวริก 36% (H2SO4) ก่อนอื่นเราต้องเพิ่มความเข้มข้นของมัน
เท 200 มล. ลงในแก้ว ซึ่งเกือบจะถึงขอบแก้ว แล้วเทมากกว่าครึ่งแก้วเล็กน้อยลงในขวด ทำเครื่องหมายด้วยปากกามาร์กเกอร์แล้วเติมส่วนที่เหลือ
ฉันติดแผ่นสะท้อนแสงไว้รอบขวดเพื่อให้ความร้อนมีประสิทธิภาพมากขึ้น แต่ต่อมาก็เอาออกเพราะมันเริ่มละลาย
ตอนนี้วางขวดไว้บนเตาแล้วระเหยไปที่ระดับของเครื่องหมายที่ตั้งไว้ก่อนหน้านี้แม้จะต่ำกว่าเล็กน้อยก็ตาม
ในเวลาเดียวกันเราพับผ้ากอซหลาย ๆ ครั้งไว้ที่มุมแล้วมัดด้วยยางยืด เตรียมสารละลายโซดาไม่อิ่มตัวแล้วจุ่มปลายมุมด้วยผ้ากอซลงไป
เมื่ออิเล็กโทรไลต์เริ่มเดือด เราก็วางมุมบนขวด โดยวางให้แน่น เรานำปลายผ้ากอซไปที่หน้าต่างที่เปิดอยู่
นี่เป็นสิ่งจำเป็นหากจู่ๆ กรดซัลฟิวริกก็เริ่มระเหยไปพร้อมกับน้ำ ถ้าคุณไม่ทำให้ขวดร้อนมากเกินไป สิ่งนี้จะไม่เกิดขึ้น
การทำงานของเครื่องเขียน:
หัวเผาของฉันมีกำลังวัตต์ค่อนข้างต่ำ ดังนั้นการระเหยจึงใช้เวลาประมาณหนึ่งชั่วโมงเตาแก๊สหรือเตาไฟฟ้าจะช่วยเร่งกระบวนการนี้ได้อย่างมาก
หลังจากเสร็จสิ้นขั้นตอนแรกแล้ว ควรเหลือสารละลายน้อยกว่าครึ่งหนึ่งเล็กน้อยในขวด นั่นคือกรดที่มีความเข้มข้นประมาณ 75% อย่าลืมเรื่องความแม่นยำ
ปล่อยให้เย็นถึงอุณหภูมิห้อง
ด่าน 2 - การคำนวณ
ตอนนี้เรามีกรดซัลฟิวริกเข้มข้นแล้ว เราก็สามารถทำปฏิกิริยาพื้นฐานได้ โดยมีลักษณะดังนี้:
แต่ก่อนอื่น เรามาคำนวณกันก่อน แล้วท้ายที่สุดเราจะเปรียบเทียบกับสิ่งที่เกิดขึ้นในทางปฏิบัติ
ดังนั้น ในตอนแรก เรามีอิเล็กโทรไลต์ 200 มล. โดยมีความหนาแน่น 1.27 g/cm³ เมื่อดูตารางความหนาแน่นของกรดซัลฟิวริก เราจะเห็นว่าความหนาแน่นนี้สอดคล้องกับความเข้มข้น 36% ลองคำนวณปริมาตรของกรด:
200มล.*36%=72มล. - ปริมาตร(H2SO4)
หลังจากที่เราระเหยสารละลายแล้ว ความเข้มข้นและความหนาแน่นของสารละลายก็เพิ่มขึ้น เราดูตารางเดียวกันและพบว่าความเข้มข้น 75% สอดคล้องกับความหนาแน่น 1.67 g/cm³
เมื่อทราบความหนาแน่นกระแส (p) และปริมาตร (V) ของกรด เราจะหามวลได้:
ม.=พี*วี;
ม.(H2SO4)=1.67ก./ซม. * 72มล.=120ก.;
ม.(H2SO4)=1.67ก./ซม. * 72มล.=120ก.;
ตอนนี้เราจำได้จากวิชาเคมีของโรงเรียน:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
โดยที่ M คือมวลโมลของสาร
โดยที่ M คือมวลโมลของสาร
มวลโมลาร์ของ H2SO4, NaCl และ HCl คือ 98, 58.5 และ 36.5 กรัม/โมล ตามลำดับ ตอนนี้เรารู้แล้วว่าต้องใช้เกลือแกงในปริมาณเท่าใด และเราจะได้ HCl เท่าใด
กล่าวคือเราต้องการ NaCl 72 กรัม นั่นคือ 34 มล. เอามาเกิน - หนึ่งในสี่ของแก้ว
เยี่ยมมาก และในทางทฤษฎี HCl จะออกมาเป็น 44.7 กรัม
ตารางความหนาแน่นของ HCl มีคอลัมน์ g/l จากนั้นเราจะหาค่าความเข้มข้น 15% - 166.4 กรัม/ลิตร ปริมาตรน้ำที่ต้องการเพื่อให้ได้ HCl 15% คือ 44.7/166.4µ270มล. เราจะใช้ 200 มล. ตามทฤษฎีแล้ว ฉันจะได้กรดไฮโดรคลอริก 22%
ด่าน 3 - การได้รับกรด
เราเชื่อมต่อทั้งสองมุมดังนี้:
และโครงสร้างทั้งหมดจะมีลักษณะดังนี้:
กรดที่เกี่ยวข้องจะควบแน่นลงในภาชนะที่มีข้อความว่า HCl โดยมีปริมาตรน้ำในนั้นคือ 200 มล. ทำเครื่องหมายระดับของเหลวปัจจุบันบนภาชนะนี้ด้วย
เราเอามุมออกแล้วเทปริมาณเกลือที่คำนวณได้ลงในขวดผ่านช่องทาง
สารละลายเปลี่ยนเป็นสีเหลือง
เพื่อให้กรดไฮโดรคลอริกเริ่มปล่อยออกมาคุณต้องเปิดเตา แต่ก่อนอื่น เรายึดมุมเข้ากับขวดและภาชนะรับให้แน่น
เมื่อกรดควบแน่นในน้ำ จะเกิด "คลื่นแนวตั้ง" นอกจากนี้สารละลายยังร้อนขึ้นและต้องทำให้เย็นลง ตัวอย่างเช่น คุณสามารถวางภาชนะอื่นที่มีน้ำแข็งอยู่ด้านล่างได้
ปฏิกิริยาจะเกิดขึ้นค่อนข้างเร็ว - 20 นาทีหลังจากนั้นคุณสามารถปิดความร้อนได้ ปล่อยให้ไอระเหยสุดท้ายของกรดไฮโดรคลอริกละลายในน้ำ จากนั้นปิดผนึกภาชนะอย่างแน่นหนา เมื่อขวดเย็นลง ให้เจือจางสารละลายที่เหลือด้วยน้ำ (ประมาณหนึ่งต่อหนึ่ง) แล้วเทลงในท่อระบายน้ำ
บรรทัดล่าง
จากเครื่องหมายบนภาชนะ เราจะกำหนดปริมาณของเหลวที่เติมลงไป สำหรับฉันมันคือ⅙นั่นคือ 17% นี่คือความเข้มข้นของกรดไฮโดรคลอริกของเรา ลองเปรียบเทียบกับอันที่ได้รับทางทฤษฎี
17%/22%*100%=77% - ผลผลิตของปฏิกิริยา
สิ่งสำคัญคือต้องทราบว่าไม่มีเอาต์พุตใดเท่ากับ 1 มักจะมีการสูญเสียอยู่เสมอ ในกรณีของฉัน นี่คืออิเล็กโทรไลต์ที่ระเหยไม่เพียงพอ ตามหลักการแล้วความเข้มข้นของกรดซัลฟิวริกควรอยู่ที่ 90-95%
เรามาตรวจสอบกรดที่เกิดขึ้นเพื่อดูปฏิกิริยากับโลหะ
เราสังเกตวิวัฒนาการอย่างรวดเร็วของไฮโดรเจน ซึ่งหมายความว่ากรดนี้เหมาะสำหรับการทดลองต่อไป
รูปแบบต่างๆ
คุณสามารถใช้ขวดแก้วเบียร์หรือโซดาที่สะอาดเป็นขวดได้ แต่ต้องให้ความร้อนได้อย่างราบรื่นที่สุด แทนที่จะใช้มุม PVC คุณสามารถใช้ท่อโพลีโพรพีลีนและมุมที่มีเส้นผ่านศูนย์กลางเล็กกว่าได้ (เหมาะสำหรับขวดของคุณ)
ฉันขอให้คุณปฏิบัติตามข้อควรระวังด้านความปลอดภัยอีกครั้ง ประสบการณ์แห่งความสุขทุกคน!
ชั้นเรียนปริญญาโทที่คล้ายกัน
น่าสนใจเป็นพิเศษ
ความคิดเห็น (19)