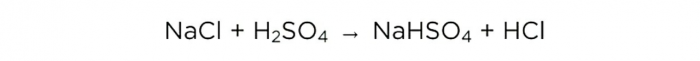Paggawa ng hydrochloric acid sa bahay
Tinawag ito ng mga alchemist na unang gumawa ng hydrochloric acid noong ika-15 siglo na “spiritus salis,” “espiritu mula sa asin.” Sa oras na iyon, ang acid na ito ay may mga mahiwagang katangian: kinakain nito ang papel, natunaw ang mga metal, at nilason ang mga tao. Ang mga pag-aari na ito ay nananatili dito hanggang sa araw na ito, ngunit ngayon ang acid na ito ay sapat na pinag-aralan, at walang magic dito.
Ang hydrochloric acid (HCl) ay isang malakas na monobasic acid, sa dalisay nitong anyo ito ay isang transparent na likido. Sa pinakamataas na konsentrasyon nito na 38% ay "naninigarilyo" ito sa hangin. Tatanggap tayo ng acid na may konsentrasyon na kalahati nito.
Kaya simulan na natin.
Mga pag-iingat sa kaligtasan
Mag-ingat kapag nagtatrabaho sa mga nakakalason na sangkap!
Ang lahat ng mga eksperimento ay dapat isagawa sa isang mahusay na maaliwalas na silid o sa ilalim ng isang talukbong. Siguraduhing magsuot ng mga salaming pangkaligtasan (maaaring bilhin sa isang tindahan ng hardware) at guwantes (kung hindi ka makahanap ng mga espesyal na guwantes na kemikal, ang mga mahusay na kalidad ay angkop para sa paghuhugas ng pinggan).
Ang baking soda ay dapat naroroon sa lugar ng eksperimento upang ma-neutralize ang acid sa isang hindi inaasahang sitwasyon (ito ay maglalabas ng carbon dioxide at tubig).
Mahigpit na ipinagbabawal na magsagawa ng mga eksperimento sa mga lalagyang metal.
Kakailanganin
Upang maisagawa ang eksperimento kakailanganin namin:
- Acid electrolyte para sa mga baterya (ibinebenta sa isang tindahan ng kotse);
- Distilled water (ibid);
- Table salt (magagamit sa anumang kusina);
- Baking soda (tingnan ang mga pag-iingat sa kaligtasan).
Mula sa mga pinggan na kailangan mo:
- Prasko ng salamin;
- Isang sisidlan na may buhangin kung saan maaari mong ilagay ang prasko;
- Maraming mga disposable tasa 200 ML;
Kung mayroon kang isang flask na lumalaban sa init, maaari mo itong painitin sa ilalim ng bukas na apoy ng isang burner. Ngunit inirerekumenda ko pa rin ang paggamit ng buhangin, kung saan ito ay sumisipsip ng acid.
Kakailanganin mo rin ang isang pares ng mga anggulo ng pagtutubero na may diameter na 50 mm at isang burner (sa aking kaso, alkohol, ngunit inirerekumenda ko ang paggamit ng isang gas).
Stage 1 - pagsingaw
Ang electrolyte para sa mga baterya ay 36% sulfuric acid (H2SO4). Una kailangan nating dagdagan ang konsentrasyon nito.
Ibuhos ang 200 ML sa baso, iyon ay, halos hanggang sa labi, at ibuhos ng kaunti pa sa kalahati ng baso sa prasko. Gumawa ng marka gamit ang isang marker at idagdag ang natitira.
Naglagay ako ng foil reflector sa paligid ng prasko para sa mas mahusay na pag-init, ngunit kalaunan ay inalis ito dahil nagsimula itong matunaw.
Ngayon ilagay ang prasko sa burner at sumingaw sa antas ng dating itinakda na marka, kahit na mas mababa ng kaunti.
Kasabay nito, inilalagay namin ang gauze na nakatiklop nang maraming beses sa sulok at sinigurado ito ng isang nababanat na banda. Maghanda ng unsaturated soda solution at isawsaw ang dulo ng sulok na may gauze dito.
Kapag nagsimulang kumulo ang electrolyte, inilalagay namin ang isang sulok sa prasko, mahigpit itong nakaupo dito. Itinuturo namin ang dulo ng gauze sa bukas na bintana.
Ito ay kinakailangan kung biglang ang sulfuric acid mismo ay nagsisimulang sumingaw kasama ng tubig. Kung hindi mo masyadong pinainit ang prasko, hindi ito mangyayari.
Gumaganap ang burner:
Ang aking burner ay medyo mababa ang wattage, kaya ang pagsingaw ay tumagal ng halos isang oras.Ang isang gas burner o electric stove ay magpapabilis nang malaki sa prosesong ito.
Matapos makumpleto ang unang yugto, ang isang maliit na mas mababa sa kalahati ng solusyon ay dapat manatili sa prasko, iyon ay, isang acid na may konsentrasyon na halos 75%. Huwag kalimutan ang tungkol sa katumpakan.
Hayaang lumamig sa temperatura ng silid.
Stage 2 - mga kalkulasyon
Ngayon na mayroon na tayong puro sulfuric acid, maaari nating isagawa ang pangunahing reaksyon, ganito ang hitsura:
Ngunit una, gawin natin ang ilang mga kalkulasyon, at sa dulo ay ihahambing natin ang mga ito sa kung ano ang nangyari sa pagsasanay.
Kaya, sa una ay mayroon kaming 200ml ng electrolyte na may density na 1.27 g/cm³. Sa pagtingin sa talahanayan ng mga density ng sulfuric acid, nakikita natin na ang density na ito ay tumutugma sa isang konsentrasyon ng 36%. Kalkulahin natin ang dami ng acid:
200ml*36%=72ml - V(H2SO4)
Pagkatapos naming sumingaw ang solusyon, ang konsentrasyon nito, at samakatuwid ang density nito, ay tumaas. Tinitingnan namin ang parehong talahanayan at nakita na ang isang konsentrasyon ng 75% ay tumutugma sa isang density ng 1.67 g/cm³.
Alam ang kasalukuyang density (p) at volume (V) ng acid, nalaman natin ang masa:
m=p*V;
m(H2SO4)=1.67g/cm³ * 72ml=120g;
m(H2SO4)=1.67g/cm³ * 72ml=120g;
Ngayon naaalala natin mula sa kimika ng paaralan:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
kung saan ang M ay ang molar mass ng substance.
kung saan ang M ay ang molar mass ng substance.
Ang molar mass ng H2SO4, NaCl at HCl ay 98, 58.5 at 36.5 g/mol, ayon sa pagkakabanggit. Ngayon ay malalaman natin kung gaano karaming table salt ang kailangan at kung gaano karaming HCl ang makukuha natin.
Ibig sabihin, kailangan natin ng 72 g ng NaCl, iyon ay 34 ml, dalhin natin ito nang labis - isang-kapat ng isang baso.
Mahusay, at ang HCl sa teorya ay lalabas sa 44.7 g.
Ang talahanayan ng density ng HCl ay may haligi ng g/l. Kinukuha namin mula doon ang halaga para sa isang konsentrasyon ng 15% - 166.4 g / l. Ang dami ng tubig na kinakailangan upang makakuha ng 15% HCl ay 44.7/166.4≈270ml. Kukuha kami ng 200ml. Bilang resulta, sa teorya, makakakuha ako ng 22% hydrochloric acid.
Stage 3 - pagkuha ng acid
Ikinonekta namin ang dalawang sulok tulad ng sumusunod:
At ang buong istraktura ay magiging ganito:
Ang katumbas na asido ay mag-condense sa isang sisidlan na may label na HCl; ang dami ng tubig sa loob nito ay 200 ml. Markahan din ang kasalukuyang antas ng likido sa lalagyang ito.
Inalis namin ang mga sulok at ibuhos ang kinakalkula na halaga ng asin sa prasko sa pamamagitan ng isang funnel.
Ang solusyon ay nagiging dilaw.
Upang simulan ang pagpapalabas ng hydrochloric acid, kailangan mong i-on ang burner. Ngunit una, mahigpit naming ikinakabit ang mga sulok sa prasko at sa tatanggap na sisidlan.
Kapag ang acid ay namumuo sa tubig, ang mga "vertical waves" ay nabuo. Gayundin, ang solusyon ay umiinit at dapat na palamig. Halimbawa, maaari kang maglagay ng isa pang sisidlan na may yelo sa ibaba.
Ang reaksyon ay nagpapatuloy nang medyo mabilis - 20 minuto, pagkatapos nito maaari mong patayin ang init. Hayaang matunaw ang mga huling singaw ng hydrochloric acid sa tubig, at pagkatapos ay i-seal ang sisidlan nang hermetically. Kapag lumamig na ang prasko, palabnawin ang natitirang solusyon sa tubig (humigit-kumulang isa hanggang isa) at ibuhos ito sa imburnal.
Bottom line
Sa pamamagitan ng marka sa sisidlan ay tinutukoy natin kung gaano karaming likido ang naidagdag. Para sa akin ito ay ⅙, iyon ay, 17%. Ito ang konsentrasyon ng ating hydrochloric acid. Ihambing natin ito sa nakuha sa teorya.
17%/22%*100%=77% - resulta ng reaksyon.
Mahalagang tandaan na walang output na katumbas ng 1, palaging may mga pagkalugi. Sa aking kaso, ito ay isang hindi sapat na evaporated electrolyte. Sa isip, ang konsentrasyon ng sulfuric acid ay dapat na 90-95%.
Suriin natin ang nagresultang acid para sa pakikipag-ugnayan sa metal.
Napansin namin ang mabilis na ebolusyon ng hydrogen. Nangangahulugan ito na ang acid ay angkop para sa karagdagang mga eksperimento.
Mga pagkakaiba-iba
Maaari kang gumamit ng isang malinis na bote ng beer o soda bilang isang prasko, ngunit sa kondisyon na ang pagpainit ay kasing makinis hangga't maaari. Sa halip na mga sulok ng PVC, maaari kang kumuha ng mga polypropylene pipe at mga sulok ng mas maliit na diameter (angkop para sa iyong prasko).
Muli kong hinihimok ka na sundin ang mga pag-iingat sa kaligtasan. Maligayang karanasan sa lahat!
Mga katulad na master class

Paggawa ng hydrochloric acid sa bahay

Pagkuha ng DNA sa bahay

Isang pinabilis na paraan ng pag-alis ng kalawang na may solusyon ng citric acid

Paggawa ng phosphor sa bahay

Isang murang paraan upang linisin ang mga spark plug at pahabain ang kanilang buhay ng serbisyo

Paano linisin ang isang French press mula sa mga deposito ng tsaa
Lalo na kawili-wili
Mga komento (19)