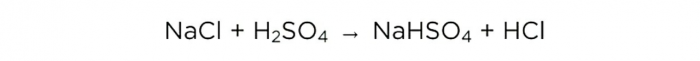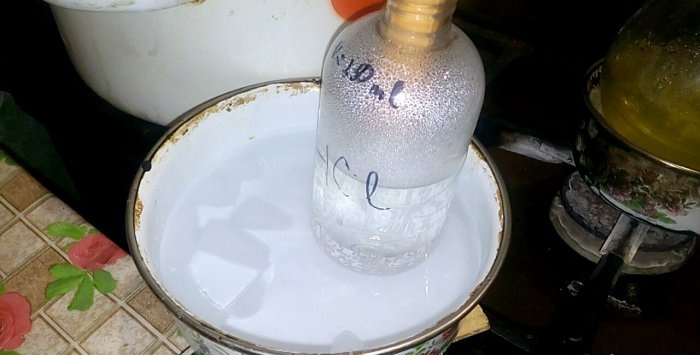Evde hidroklorik asit yapımı
Hidroklorik asidi ilk kez 15. yüzyılda üreten simyacılar buna "spiritus salis", "tuzdan gelen ruh" adını verdiler. O zamanlar bu asidin sihirli özellikleri vardı: Kağıdı aşındırdı, metalleri eritti ve insanları zehirledi. Bu özellikler bugüne kadar korunmuştur, ancak artık bu asit yeterince incelenmiştir ve burada hiçbir sihir yoktur.
Hidroklorik asit (HCl) güçlü bir monobazik asittir, saf haliyle şeffaf bir sıvıdır. Maksimum %38 konsantrasyonunda havada “duman çıkarır”. Bunun yarısı kadar konsantrasyonda asit alacağız.
Öyleyse başlayalım.
Güvenlik önlemleri
Zehirli maddelerle çalışırken dikkatli olun!
Tüm deneyler iyi havalandırılmış bir odada veya bir başlık altında yapılmalıdır.Koruyucu gözlük (hırdavatçıdan satın alınabilir) ve eldiven (özel kimyasal eldiven bulamazsanız, kaliteli olanlar uygundur) taktığınızdan emin olun. bulaşıkları yıkamak için).
Öngörülemeyen bir durumda asidi nötralize etmek için deney alanında kabartma tozu bulunmalıdır (bu, karbondioksit ve su açığa çıkaracaktır).
Metal kaplarda deney yapmak kesinlikle yasaktır.
Gerekecek
Deneyi gerçekleştirmek için ihtiyacımız olacak:
- Aküler için asit elektrolit (bir araba mağazasında satılır);
- Damıtılmış su (aynı eser);
- Sofra tuzu (her mutfakta bulunur);
- Kabartma tozu (güvenlik önlemlerine bakın).
İhtiyacınız olan yemeklerden:
- Cam şişe;
- Şişeyi yerleştirebileceğiniz kumlu bir kap;
- Birkaç adet tek kullanımlık bardak 200 ml;
Isıya dayanıklı bir mataranız varsa, onu açık ateş altında ısıtabilirsiniz. Ama yine de kum kullanmanızı tavsiye ederim, bu durumda asit emecektir.
Ayrıca 50 mm çapında bir çift sıhhi tesisat açısına ve bir brülöre ihtiyacınız olacak (benim durumumda alkol, ancak gazlı olanı kullanmanızı öneririm).
Aşama 1 - buharlaşma
Aküler için elektrolit %36 sülfürik asittir (H2SO4). Öncelikle konsantrasyonunu arttırmamız gerekiyor.
Bardağa 200 ml, yani neredeyse ağzına kadar dökün ve bardağın yarısından biraz fazlasını şişeye dökün. Bir işaretleyici ile işaretleyin ve gerisini ekleyin.
Daha etkili ısıtma için şişenin etrafına folyo reflektör yerleştirdim ancak daha sonra erimeye başladığı için onu çıkardım.
Şimdi şişeyi brülörün üzerine koyun ve önceden ayarlanan işaret seviyesine, hatta biraz daha düşük seviyeye kadar buharlaştırın.
Aynı zamanda köşeye birkaç kez katlanmış gazlı bez koyup elastik bir bantla sabitliyoruz. Doymamış bir soda çözeltisi hazırlayın ve köşenin ucunu gazlı bezle içine daldırın.
Elektrolit kaynamaya başladığında şişenin üzerine bir köşe koyarız, üzerine sıkıca oturur. Gazlı bezin ucunu açık pencereye yönlendiriyoruz.
Aniden sülfürik asidin kendisi de suyla birlikte buharlaşmaya başlarsa bu gereklidir. Şişeyi çok fazla ısıtmazsanız bu gerçekleşmeyecektir.
Brülör çalışırken:
Brülörüm nispeten düşük güçte olduğundan buharlaşma yaklaşık bir saat sürdü.Bir gaz ocağı veya elektrikli soba bu süreci önemli ölçüde hızlandıracaktır.
İlk aşamayı tamamladıktan sonra şişede çözeltinin yarısından biraz daha azı, yani konsantrasyonu yaklaşık% 75 olan bir asit kalmalıdır. Doğruluğu unutmayın.
Oda sıcaklığına soğumaya bırakın.
Aşama 2 - hesaplamalar
Artık sülfürik asidi konsantre ettiğimize göre temel reaksiyonu gerçekleştirebiliriz, şöyle görünür:
Ama önce bazı hesaplamalar yapalım ve sonunda bunları pratikte olanlarla karşılaştıracağız.
Yani başlangıçta 1,27 g/cm³ yoğunluğa sahip 200 ml elektrolitimiz vardı. Sülfürik asit yoğunlukları tablosuna baktığımızda bu yoğunluğun %36'lık bir konsantrasyona karşılık geldiğini görüyoruz. Asidin hacmini hesaplayalım:
200ml*%36=72ml - V(H2SO4)
Çözeltiyi buharlaştırdıktan sonra konsantrasyonu ve dolayısıyla yoğunluğu arttı. Aynı tabloya baktığımızda %75'lik bir konsantrasyonun 1,67 g/cm³ yoğunluğa karşılık geldiğini görüyoruz.
Asidin akım yoğunluğunu (p) ve hacmini (V) bilerek kütleyi buluruz:
m=p*V;
m(H2SO4)=1,67g/cm³ * 72ml=120g;
m(H2SO4)=1,67g/cm³ * 72ml=120g;
Şimdi okul kimyasından hatırlıyoruz:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
burada M maddenin molar kütlesidir.
burada M maddenin molar kütlesidir.
H2SO4, NaCl ve HCl'nin molar kütleleri sırasıyla 98, 58,5 ve 36,5 g/mol'dür. Artık ne kadar sofra tuzuna ihtiyacımız olduğunu ve ne kadar HCl alacağımızı öğrenebiliriz.
Yani 72 gr NaCl'e ihtiyacımız var, yani 34 ml, hadi fazla alalım - bardağın çeyreği.
Harika ve teoride HCl 44,7 g'a çıkacak.
HCl yoğunluk tablosunda bir g/l sütunu vardır. Buradan %15 - 166,4 g/l konsantrasyon değerini alıyoruz. %15 HCl elde etmek için gereken su hacmi 44,7/166,4≈270 ml'dir. 200 ml alacağız. Sonuç olarak teorik olarak% 22 hidroklorik asit elde edeceğim.
Aşama 3 - asit elde etme
İki köşeyi şu şekilde birleştiriyoruz:
Ve tüm yapı şöyle görünecek:
Karşılık gelen asit, HCl etiketli bir kapta yoğunlaşacaktır; içindeki suyun hacmi 200 ml'dir. Ayrıca bu kaptaki mevcut sıvı seviyesini de işaretleyin.
Köşeleri kaldırıyoruz ve hesaplanan tuz miktarını bir huni aracılığıyla şişeye döküyoruz.
Çözelti sarıya döner.
Hidroklorik asitin salınmaya başlaması için brülörü açmanız gerekir. Ama önce köşeleri şişeye ve alıcı kaba sıkıca tutturuyoruz.
Asit suda yoğunlaştığında “dikey dalgalar” oluşur. Ayrıca çözelti ısınır ve soğutulması gerekir. Örneğin altına buzlu başka bir kap yerleştirebilirsiniz.
Reaksiyon nispeten hızlı bir şekilde ilerler - 20 dakika sonra ısıyı kapatabilirsiniz. Hidroklorik asitin son buharlarının suda çözülmesini bekleyin ve ardından kabı hava geçirmez şekilde kapatın. Şişe soğuduğunda, kalan çözeltiyi suyla (yaklaşık bire bir) seyreltin ve kanalizasyona dökün.
Sonuç olarak
Kabın üzerindeki işarete göre ne kadar sıvı eklendiğini belirleriz. Benim için bu ⅙, yani %17. Bu hidroklorik asitimizin konsantrasyonudur. Bunu teoride elde edilenle karşılaştıralım.
%17/%22*%100=%77 - reaksiyon verimi.
1'e eşit bir çıktı olmadığını, her zaman kayıpların olduğunu unutmamak önemlidir. Benim durumumda bu, yeterince buharlaşmayan bir elektrolittir. İdeal olarak sülfürik asit konsantrasyonu %90-95 olmalıdır.
Ortaya çıkan asidin metalle etkileşimi açısından kontrol edelim.
Hidrojenin hızlı evrimini gözlemliyoruz. Bu, asidin daha sonraki deneyler için uygun olduğu anlamına gelir.
Varyasyonlar
Şişe olarak temiz bir cam şişe bira veya soda kullanabilirsiniz, ancak ısıtmanın mümkün olduğu kadar yumuşak olması şartıyla. PVC köşeler yerine polipropilen borular ve daha küçük çaplı (şişenize uygun) köşeler alabilirsiniz.
Bir kez daha güvenlik önlemlerine uymanızı rica ediyorum. Herkese mutlu deneyimler!
Benzer ana sınıflar
Özellikle ilginç
Yorumlar (19)