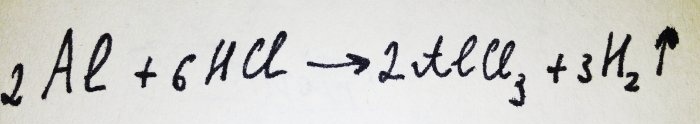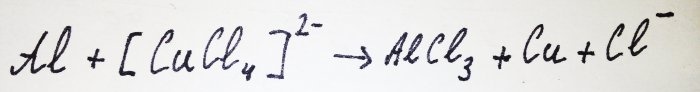Прост експеримент - Син пламък
Добър ден, любознателни химици! Днес ще проведем прост, но ефектен експеримент.
Същността му е, че отделеният по време на реакцията водород гори със син пламък.
И така, ще ни трябва:
Ще проведем експеримента в стъклен буркан.
Можете да използвате петриево блюдо или чаша като съд. Не препоръчвам да използвате колба, тъй като притокът на кислород вътре ще бъде затруднен поради тясното гърло на колбата.
Преди да проведете този експеримент, горещо ви препоръчвам да се запознаете с предпазните мерки при работа с киселини.
Изсипете чаена лъжичка витриол в буркан и добавете 40 ml киселина. Разтворът става зелен поради образуването на сложен меден йон тетрахлорокупрат [CuCl4]2-.
Сега остава само да добавите алуминиевото фолио. Той е покрит с оксиден филм, но полученият комплекс бързо го разрушава. След това част от алуминия реагира с киселината, уравнението за тази реакция е:
Както се вижда от реакцията, се отделя водород.
Останалата част от алуминия взаимодейства с комплекса, измествайки медта от него:
Реакциите протичат бързо, като се отделя голямо количество топлина.
Отделеният водород гори добре във въздуха, нека го запалим.
Тесният поток на пламъка е свързан с характеристиките на гърлото на буркана, а наситеният син цвят му се придава от медните йони, които присъстват в разтвора.
Нека направим същия експеримент, но в различен контейнер:
Когато целият алуминий реагира, разтворът става сив с петна от редуцирана мед по повърхността. Трябва да се разреди с много вода и да се излее в канала.
На дъното има останала утайка:
Трябва също да се отървете от него, тъй като след опит за филтриране върху филтъра остана светлокафява утайка и не може да се нарече мед.
И това приключва тази статия. Този опит може да се демонстрира в часовете по химия в училище. Успех на всички с повторението!
Същността му е, че отделеният по време на реакцията водород гори със син пламък.
Реактиви
И така, ще ни трябва:
- Концентрация на солна киселина 15%;
- Меден сулфат;
- Алуминиево фолио.
Ще проведем експеримента в стъклен буркан.
Можете да използвате петриево блюдо или чаша като съд. Не препоръчвам да използвате колба, тъй като притокът на кислород вътре ще бъде затруднен поради тясното гърло на колбата.
Експериментирайте
Преди да проведете този експеримент, горещо ви препоръчвам да се запознаете с предпазните мерки при работа с киселини.
Изсипете чаена лъжичка витриол в буркан и добавете 40 ml киселина. Разтворът става зелен поради образуването на сложен меден йон тетрахлорокупрат [CuCl4]2-.
Сега остава само да добавите алуминиевото фолио. Той е покрит с оксиден филм, но полученият комплекс бързо го разрушава. След това част от алуминия реагира с киселината, уравнението за тази реакция е:
Както се вижда от реакцията, се отделя водород.
Останалата част от алуминия взаимодейства с комплекса, измествайки медта от него:
Реакциите протичат бързо, като се отделя голямо количество топлина.
Отделеният водород гори добре във въздуха, нека го запалим.
Тесният поток на пламъка е свързан с характеристиките на гърлото на буркана, а наситеният син цвят му се придава от медните йони, които присъстват в разтвора.
Нека направим същия експеримент, но в различен контейнер:
Когато целият алуминий реагира, разтворът става сив с петна от редуцирана мед по повърхността. Трябва да се разреди с много вода и да се излее в канала.
На дъното има останала утайка:
Трябва също да се отървете от него, тъй като след опит за филтриране върху филтъра остана светлокафява утайка и не може да се нарече мед.
Заключение
И това приключва тази статия. Този опит може да се демонстрира в часовете по химия в училище. Успех на всички с повторението!
Подобни майсторски класове
Особено интересно
Коментари (2)