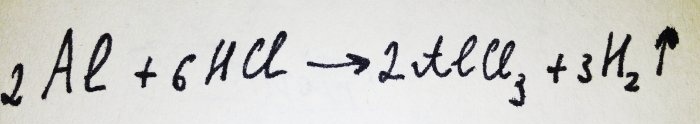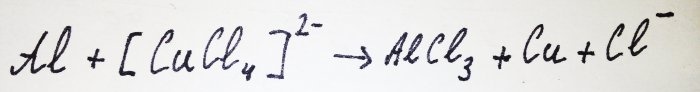تجربة بسيطة - اللهب الأزرق
يوم جيد أيها الكيميائيون الفضوليون! اليوم سنجري تجربة بسيطة ولكنها مذهلة.
جوهرها هو أن الهيدروجين المنطلق أثناء التفاعل يحترق بلهب أزرق.
لذلك، سنحتاج إلى:
سنقوم بإجراء التجربة في وعاء زجاجي.
يمكنك استخدام طبق بيتري أو كوب كسفينة. لا أنصح باستخدام الدورق، لأن تدفق الأكسجين إلى الداخل سيكون صعبًا بسبب ضيق عنق الدورق.
قبل إجراء هذه التجربة، أوصي بشدة بالتعرف على احتياطات السلامة عند العمل مع الأحماض.
صب ملعقة صغيرة من الزاج في وعاء وأضف 40 مل من الحمض. يتحول المحلول إلى اللون الأخضر نتيجة لتكوين أيون النحاس المعقد رباعي كلوروكوبرات [CuCl4]2-.
الآن كل ما تبقى هو إضافة رقائق الألومنيوم. إنه مغطى بفيلم أكسيد، لكن المجمع الناتج يدمره بسرعة. ثم يتفاعل بعض الألومنيوم مع الحمض، ومعادلة هذا التفاعل هي:
وكما يتبين من التفاعل، يتم تحرير الهيدروجين.
ويتفاعل باقي الألومنيوم مع المعقد، مما يؤدي إلى إزاحة النحاس منه:
تحدث التفاعلات بسرعة، مما يؤدي إلى إطلاق كميات كبيرة من الحرارة.
الهيدروجين المنطلق يحترق جيدًا في الهواء، فلنشعل النار فيه.
ويرتبط تدفق اللهب الضيق بخصائص عنق الجرة، ويعطى اللون الأزرق الغني له بواسطة أيونات النحاس الموجودة في المحلول.
لنقم بنفس التجربة، ولكن في حاوية مختلفة:
عندما يتفاعل كل الألومنيوم، يتحول المحلول إلى اللون الرمادي مع وجود بقع من النحاس المخفف على السطح. يجب تخفيفه بكمية كبيرة من الماء وسكبه في البالوعة.
هناك رواسب متبقية في الأسفل:
يجب عليك أيضا التخلص منه، لأنه بعد محاولة التصفية، بقي راسب بني فاتح على الفلتر، ولا يمكن أن يسمى النحاس.
وبهذا ينتهي هذا المقال. يمكن إثبات هذه التجربة في دروس الكيمياء في المدرسة. حظا سعيدا مع تكرار الجميع!
جوهرها هو أن الهيدروجين المنطلق أثناء التفاعل يحترق بلهب أزرق.
الكواشف
لذلك، سنحتاج إلى:
- تركيز حمض الهيدروكلوريك 15%؛
- كبريتات النحاس.
- رقائق الألمنيوم.
سنقوم بإجراء التجربة في وعاء زجاجي.
يمكنك استخدام طبق بيتري أو كوب كسفينة. لا أنصح باستخدام الدورق، لأن تدفق الأكسجين إلى الداخل سيكون صعبًا بسبب ضيق عنق الدورق.
تجربة
قبل إجراء هذه التجربة، أوصي بشدة بالتعرف على احتياطات السلامة عند العمل مع الأحماض.
صب ملعقة صغيرة من الزاج في وعاء وأضف 40 مل من الحمض. يتحول المحلول إلى اللون الأخضر نتيجة لتكوين أيون النحاس المعقد رباعي كلوروكوبرات [CuCl4]2-.
الآن كل ما تبقى هو إضافة رقائق الألومنيوم. إنه مغطى بفيلم أكسيد، لكن المجمع الناتج يدمره بسرعة. ثم يتفاعل بعض الألومنيوم مع الحمض، ومعادلة هذا التفاعل هي:
وكما يتبين من التفاعل، يتم تحرير الهيدروجين.
ويتفاعل باقي الألومنيوم مع المعقد، مما يؤدي إلى إزاحة النحاس منه:
تحدث التفاعلات بسرعة، مما يؤدي إلى إطلاق كميات كبيرة من الحرارة.
الهيدروجين المنطلق يحترق جيدًا في الهواء، فلنشعل النار فيه.
ويرتبط تدفق اللهب الضيق بخصائص عنق الجرة، ويعطى اللون الأزرق الغني له بواسطة أيونات النحاس الموجودة في المحلول.
لنقم بنفس التجربة، ولكن في حاوية مختلفة:
عندما يتفاعل كل الألومنيوم، يتحول المحلول إلى اللون الرمادي مع وجود بقع من النحاس المخفف على السطح. يجب تخفيفه بكمية كبيرة من الماء وسكبه في البالوعة.
هناك رواسب متبقية في الأسفل:
يجب عليك أيضا التخلص منه، لأنه بعد محاولة التصفية، بقي راسب بني فاتح على الفلتر، ولا يمكن أن يسمى النحاس.
خاتمة
وبهذا ينتهي هذا المقال. يمكن إثبات هذه التجربة في دروس الكيمياء في المدرسة. حظا سعيدا مع تكرار الجميع!
فصول رئيسية مماثلة
مثيرة للاهتمام بشكل خاص
التعليقات (2)