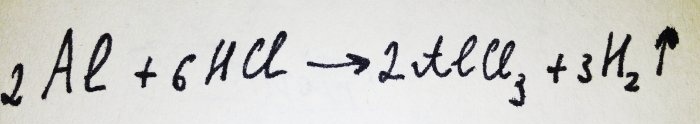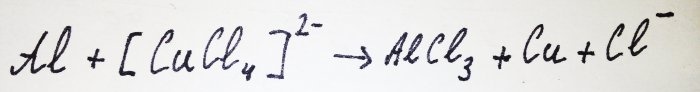Un experiment senzill: flama blava
Bon dia, químics curiosos! Avui farem un experiment senzill però espectacular.
La seva essència és que l'hidrogen alliberat durant la reacció crema amb una flama blava.
Per tant, necessitarem:
Farem l'experiment en un pot de vidre.
Podeu utilitzar una placa de Petri o un vas de precipitats com a recipient. No recomano utilitzar un matràs, ja que el flux d'oxigen a l'interior serà difícil a causa del coll estret del matràs.
Abans de dur a terme aquest experiment, us recomano que us familiaritzeu amb les precaucions de seguretat quan treballeu amb àcids.
Aboqueu una culleradeta de vitriol en un pot i afegiu-hi 40 ml d'àcid. La solució es torna verda a causa de la formació de complexos ions de coure tetraclorocuprat [CuCl4]2-.
Ara només falta afegir el paper d'alumini. Està cobert amb una pel·lícula d'òxid, però el complex resultant el destrueix ràpidament. Aleshores, part de l'alumini reacciona amb l'àcid, l'equació d'aquesta reacció és:
Com es pot veure a la reacció, s'allibera hidrogen.
La resta de l'alumini interacciona amb el complex, desplaçant-ne el coure:
Les reaccions es produeixen ràpidament, alliberant grans quantitats de calor.
L'hidrogen alliberat crema bé a l'aire, encenem-lo.
El flux de flama estret s'associa amb les característiques del coll del pot, i el ric color blau li donen els ions de coure que hi ha a la solució.
Fem el mateix experiment, però en un contenidor diferent:
Quan tot l'alumini ha reaccionat, la solució es torna grisa amb taques de coure reduït a la superfície. S'ha de diluir amb aigua abundant i abocar-lo pel desguàs.
Queden sediments a la part inferior:
També hauríeu de desfer-se'n, ja que després d'intentar filtrar, va quedar un precipitat marró clar al filtre i no es pot anomenar coure.
I això conclou aquest article. Aquesta experiència es pot demostrar a les classes de química a l'escola. Molta sort a tots amb la vostra repetició!
La seva essència és que l'hidrogen alliberat durant la reacció crema amb una flama blava.
Reactius
Per tant, necessitarem:
- Concentració d'àcid clorhídric 15%;
- sulfat de coure;
- Paper d'alumini.
Farem l'experiment en un pot de vidre.
Podeu utilitzar una placa de Petri o un vas de precipitats com a recipient. No recomano utilitzar un matràs, ja que el flux d'oxigen a l'interior serà difícil a causa del coll estret del matràs.
Experimenta
Abans de dur a terme aquest experiment, us recomano que us familiaritzeu amb les precaucions de seguretat quan treballeu amb àcids.
Aboqueu una culleradeta de vitriol en un pot i afegiu-hi 40 ml d'àcid. La solució es torna verda a causa de la formació de complexos ions de coure tetraclorocuprat [CuCl4]2-.
Ara només falta afegir el paper d'alumini. Està cobert amb una pel·lícula d'òxid, però el complex resultant el destrueix ràpidament. Aleshores, part de l'alumini reacciona amb l'àcid, l'equació d'aquesta reacció és:
Com es pot veure a la reacció, s'allibera hidrogen.
La resta de l'alumini interacciona amb el complex, desplaçant-ne el coure:
Les reaccions es produeixen ràpidament, alliberant grans quantitats de calor.
L'hidrogen alliberat crema bé a l'aire, encenem-lo.
El flux de flama estret s'associa amb les característiques del coll del pot, i el ric color blau li donen els ions de coure que hi ha a la solució.
Fem el mateix experiment, però en un contenidor diferent:
Quan tot l'alumini ha reaccionat, la solució es torna grisa amb taques de coure reduït a la superfície. S'ha de diluir amb aigua abundant i abocar-lo pel desguàs.
Queden sediments a la part inferior:
També hauríeu de desfer-se'n, ja que després d'intentar filtrar, va quedar un precipitat marró clar al filtre i no es pot anomenar coure.
Conclusió
I això conclou aquest article. Aquesta experiència es pot demostrar a les classes de química a l'escola. Molta sort a tots amb la vostra repetició!
Classes magistrals similars
Particularment interessant
Comentaris (2)