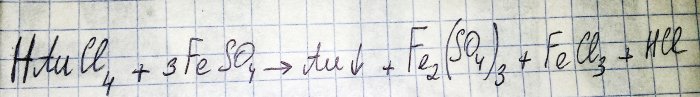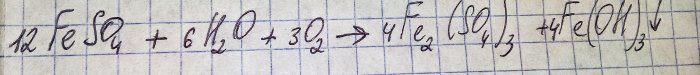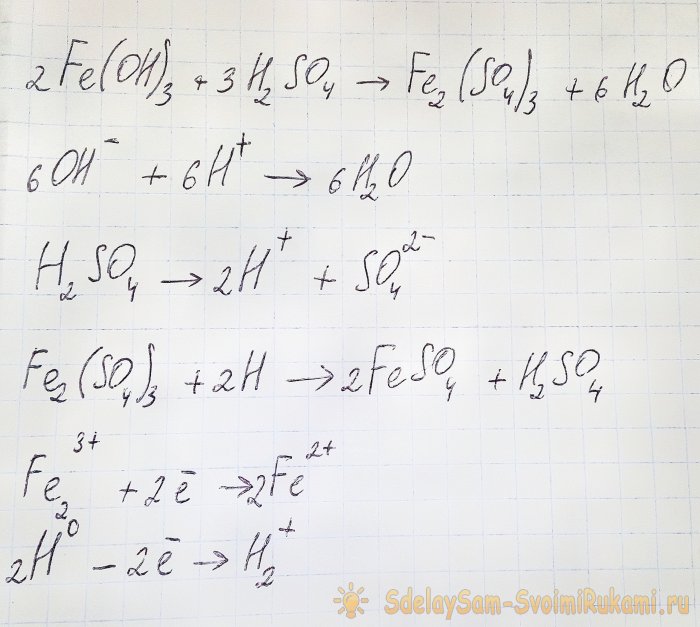Una manera ràpida d'obtenir sulfat fèrric del fertilitzant
El penúltim pas en el camí cap a l'obtenció d'un metall noble a partir de components de ràdio és la reducció d'aquest últim del clorur corresponent. El sulfat de ferro (II) és excel·lent per a aquests propòsits. Considereu l'equació d'aquesta reacció:
HAuCl4 - tetracloroaurat d'hidrogen (III) - un compost que es forma quan l'or es dissol a l'aigua regia. De moment no aprofundirem en aquest procés, ja que mereix un article a part.
Per tant, el sulfat (d'ara endavant s'entén sulfat de ferro (II)) és un dels agents reductors barats i fàcilment disponibles. A les botigues es pot trobar amb el nom de "sulfat de ferro", és un fertilitzant. Però aquesta no és una substància pura, la proporció de sulfat en ella és d'aproximadament el 50%, la resta són impureses. I abans de poder restaurar l'or, hem de purificar el nostre sulfat.
Necessitarem
Per a això necessitareu:
- Sulfat de ferro (es ven a les botigues com "tot per al jardí"; vaig comprar un quilo per tenir prou per al cap);
- Solució d'àcid sulfúric, també conegut com a electròlit àcid per a bateries (en concessionaris d'automòbils);
- Alcohol, vaig utilitzar un 95%;
- Vaixella química o d'un sol ús (tasses, culleres de remenar).
Obtenim sulfat de ferro del fertilitzant
Utilitzo un pot de vidre per preparar la solució. A dins hi ha 500 ml d'aigua calenta, potser una mica menys.
Ara mesura aproximadament mig got d'adob:
Com podeu veure, la substància és de color groc-marró; aquest "sulfat" brut només es pot utilitzar per al seu propòsit: ruixar la vegetació. Tenim altres objectius.
Aboqueu-ho al pot:
La solució va esdevenir un color marró desagradable. La coloració es va produir a causa de la reacció del fertilitzant amb l'aigua:
El ferro en sulfat s'oxida a trivalent i l'hidròxid de ferro (III) precipita, que és en realitat la raó del seu color.
Per obtenir el sulfat que ens interessa dels compostos resultants, cal acidificar la solució amb àcid sulfúric. Afegiu-hi petites porcions fins que la solució s'aclareixi.
En aquest cas, es produeixen les reaccions següents:
L'hidròxid reacciona amb l'àcid per formar sulfat de ferro (III) (reacció d'intercanvi iònic). Al seu torn reacciona amb l'hidrogen atòmic, que es forma durant la dissociació de l'àcid sulfúric. L'última reacció és redox.
Ara la solució conté exactament el sulfat que necessitem, però la solució en si encara està ennuvolada. Deixa-ho reposar i filtra-ho, vaig fer servir un filtre químic.
Les impureses insolubles van quedar al fons del pot:
Ho esbandim i hi aboquem la solució filtrada. És molt més lleuger i net que l'original.
L'alcohol etílic desplaça les sals dels àcids dibàsics de les seves solucions. Utilitzarem aquesta propietat per obtenir sulfat sòlid. Afegim alcohol a la solució, vaig abocar 200 ml, que és igual en volum a una mica més de la meitat del volum original de fertilitzant.
A la part inferior van aparèixer cristalls del nostre sulfat.
Vaig deixar la solució durant dos dies perquè tot el sulfat tingués temps de precipitar.
Inicialment podeu afegir més alcohol per fer aquest procés més ràpid.
Escorreu el líquid, fent tocs a la part inferior i escalfant suaument, separeu el sulfat del pot i aboqueu-lo sobre una tovallola de paper perquè s'assequi.
Al cap d'unes hores, aboqueu el sulfat en un pot de vidre, etiqueteu la substància i d'aquesta forma es pot emmagatzemar durant molt de temps.
Com que els hidrats cristal·lins van precipitar, la fórmula de la substància és com a la imatge. Però això no ens impedeix utilitzar-lo per als nostres propis propòsits, dissolent-lo en aigua de totes maneres.
Conclusió
Les precaucions de seguretat i el compliment de les normes de manipulació d'àcids són un fet. En cap cas ens hem d'oblidar d'ells.
Substàncies netes per a tothom!
Classes magistrals similars
Particularment interessant
Comentaris (1)