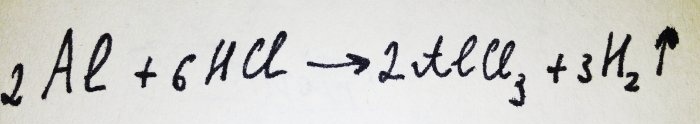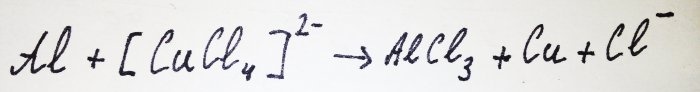Jednoduchý experiment - Modrý plamen
Hezký den, zvídaví chemici! Dnes provedeme jednoduchý, ale velkolepý experiment.
Jeho podstatou je, že vodík uvolněný při reakci hoří modrým plamenem.
Budeme tedy potřebovat:
Pokus provedeme ve skleněné nádobě.
Jako nádobu můžete použít Petriho misku nebo kádinku. Nedoporučuji používat baňku, protože proudění kyslíku uvnitř bude obtížné kvůli úzkému hrdlu baňky.
Před provedením tohoto experimentu důrazně doporučuji, abyste se seznámili s bezpečnostními opatřeními při práci s kyselinami.
Nalijte lžičku vitriolu do sklenice a přidejte 40 ml kyseliny. Roztok zezelená v důsledku tvorby komplexního iontu měďnatého tetrachloroměďnatého [CuCl4]2-.
Teď už zbývá jen přidat alobal. Je pokrytý oxidovým filmem, ale výsledný komplex jej rychle ničí. Potom část hliníku reaguje s kyselinou, rovnice pro tuto reakci je:
Jak je vidět z reakce, uvolňuje se vodík.
Zbytek hliníku interaguje s komplexem a vytlačuje z něj měď:
Reakce probíhají rychle, přičemž se uvolňuje velké množství tepla.
Uvolněný vodík dobře hoří na vzduchu, pojďme ho zapálit.
Úzký tok plamene je spojen s charakteristikami hrdla nádoby a sytě modrou barvu mu dodávají ionty mědi, které jsou přítomny v roztoku.
Udělejme stejný experiment, ale v jiné nádobě:
Když všechen hliník zreaguje, roztok zešedne se skvrnami redukované mědi na povrchu. Měl by být zředěn velkým množstvím vody a nalit do kanalizace.
Na dně zůstal sediment:
Měli byste se ho také zbavit, protože po pokusu o filtraci zůstala na filtru světle hnědá sraženina, kterou nelze nazvat mědí.
A tím tento článek končí. Tuto zkušenost lze prokázat v hodinách chemie ve škole. Hodně štěstí při opakování všem!
Jeho podstatou je, že vodík uvolněný při reakci hoří modrým plamenem.
Reagencie
Budeme tedy potřebovat:
- Koncentrace kyseliny chlorovodíkové 15 %;
- síran měďnatý;
- Alobal.
Pokus provedeme ve skleněné nádobě.
Jako nádobu můžete použít Petriho misku nebo kádinku. Nedoporučuji používat baňku, protože proudění kyslíku uvnitř bude obtížné kvůli úzkému hrdlu baňky.
Experiment
Před provedením tohoto experimentu důrazně doporučuji, abyste se seznámili s bezpečnostními opatřeními při práci s kyselinami.
Nalijte lžičku vitriolu do sklenice a přidejte 40 ml kyseliny. Roztok zezelená v důsledku tvorby komplexního iontu měďnatého tetrachloroměďnatého [CuCl4]2-.
Teď už zbývá jen přidat alobal. Je pokrytý oxidovým filmem, ale výsledný komplex jej rychle ničí. Potom část hliníku reaguje s kyselinou, rovnice pro tuto reakci je:
Jak je vidět z reakce, uvolňuje se vodík.
Zbytek hliníku interaguje s komplexem a vytlačuje z něj měď:
Reakce probíhají rychle, přičemž se uvolňuje velké množství tepla.
Uvolněný vodík dobře hoří na vzduchu, pojďme ho zapálit.
Úzký tok plamene je spojen s charakteristikami hrdla nádoby a sytě modrou barvu mu dodávají ionty mědi, které jsou přítomny v roztoku.
Udělejme stejný experiment, ale v jiné nádobě:
Když všechen hliník zreaguje, roztok zešedne se skvrnami redukované mědi na povrchu. Měl by být zředěn velkým množstvím vody a nalit do kanalizace.
Na dně zůstal sediment:
Měli byste se ho také zbavit, protože po pokusu o filtraci zůstala na filtru světle hnědá sraženina, kterou nelze nazvat mědí.
Závěr
A tím tento článek končí. Tuto zkušenost lze prokázat v hodinách chemie ve škole. Hodně štěstí při opakování všem!
Podobné mistrovské kurzy
Zvláště zajímavé
Komentáře (2)