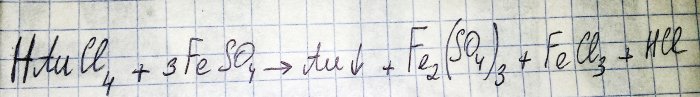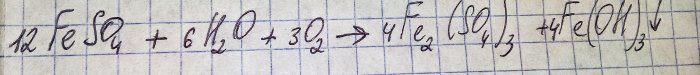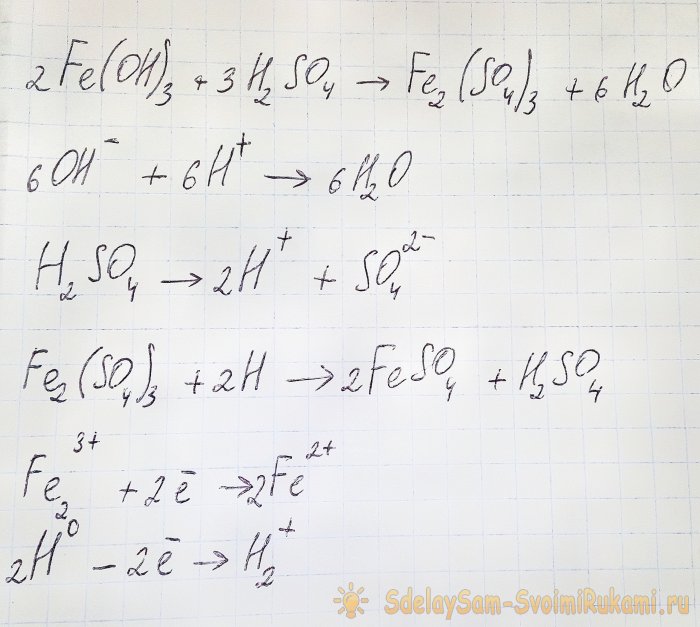En hurtig måde at opnå jernsulfat fra gødning
Det næstsidste trin på vejen til at opnå et ædelmetal fra radiokomponenter er reduktionen af sidstnævnte fra det tilsvarende chlorid. Jern(II)sulfat er fremragende til disse formål. Overvej ligningen for denne reaktion:
HAuCl4 - hydrogentetrachloraurat (III) - en forbindelse, der dannes, når guld opløses i aqua regia. Vi vil ikke gå dybere ind i denne proces for nu, da den fortjener en separat artikel.
Så sulfat (herefter menes jern(II)sulfat) er et af de billige og let tilgængelige reduktionsmidler. I butikkerne kan det findes under navnet "jernsulfat", det er en gødning. Men dette er ikke et rent stof, andelen af sulfat i det er omkring 50%, resten er urenheder. Og før vi kan genoprette guldet, skal vi rense vores sulfat.
Vil behøve
Til dette skal du bruge:
- Jernsulfat (sælges i butikker som "alt til haven"; jeg købte et kilo, så jeg ville have nok til mit hoved);
- Svovlsyreopløsning, også kendt som syreelektrolyt til batterier (i bilforhandlere);
- Alkohol, jeg brugte 95%;
- Kemisk eller engangsservice (kopper, røreskeer).
Vi får jernsulfat fra gødning
Jeg bruger en glaskrukke til at forberede opløsningen. Indeni er der 500 ml varmt vand, måske lidt mindre.
Mål nu cirka et halvt glas gødning:
Som du kan se, er stoffet gulbrun i farven; sådan snavset "sulfat" kan kun bruges til det tilsigtede formål - at sprøjte vegetation. Vi har andre mål.
Hæld det i krukken:
Opløsningen fik en ubehagelig brun farve. Farvningen opstod på grund af gødningens reaktion med vand:
Jern i sulfat oxideres til trivalent, og jern(III)hydroxid udfældes, hvilket faktisk er årsagen til dets farve.
For at opnå det sulfat, vi er interesseret i, fra de resulterende forbindelser, er det nødvendigt at forsure opløsningen med svovlsyre. Tilsæt i små portioner, indtil opløsningen lysner.
I dette tilfælde opstår følgende reaktioner:
Hydroxidet reagerer med syren og danner jern(III)sulfat (ionbytterreaktion). Det reagerer igen med atomart brint, som dannes under dissociationen af svovlsyre. Den sidste reaktion er redox.
Nu indeholder opløsningen præcis det sulfat, vi skal bruge, men selve opløsningen er stadig uklar. Lad det sidde og filtrere det, jeg brugte et kemisk filter.
Uopløselige urenheder forblev i bunden af krukken:
Vi skyller det og hælder den filtrerede opløsning i det. Den er meget lettere og renere end originalen.
Ethylalkohol fortrænger salte af dibasiske syrer fra deres opløsninger. Vi vil bruge denne egenskab til at opnå fast sulfat. Vi tilføjer alkohol til opløsningen, jeg hældte 200 ml, hvilket er lige i volumen til lidt mere end halvdelen af det oprindelige volumen af gødning.
Krystaller af vores sulfat dukkede op i bunden.
Jeg forlod opløsningen i to dage, så alt sulfatet havde tid til at udfældes.
Du kan i første omgang tilføje mere alkohol for at gøre denne proces hurtigere.
Dræn væsken ved at banke på bunden og forsigtig opvarmning, adskille sulfatet fra glasset og hæld det på et køkkenrulle for at tørre.
Efter et par timer, hæld sulfatet i en glaskrukke, mærk stoffet, og i denne form kan det opbevares i lang tid.
Da krystallinske hydrater udfældedes, er formlen for stoffet som på billedet. Men det forhindrer os ikke i at bruge det til vores egne formål og alligevel opløse det i vand.
Konklusion
Sikkerhedsforanstaltninger og overholdelse af reglerne for håndtering af syrer er givet. Vi må under ingen omstændigheder glemme dem.
Rene stoffer til alle!
Lignende mesterklasser
Særlig interessant
Kommentarer (1)