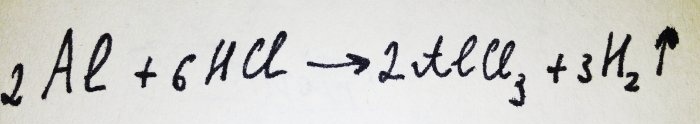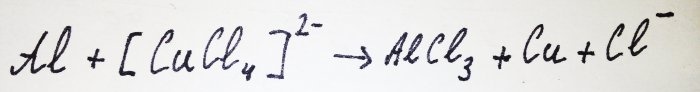Un experimento sencillo: llama azul
¡Buenos días, químicos curiosos! Hoy realizaremos un experimento simple pero espectacular.
Su esencia es que el hidrógeno liberado durante la reacción arde con una llama azul.
Entonces, necesitaremos:
Realizaremos el experimento en un frasco de vidrio.
Puedes utilizar una placa de Petri o un vaso de precipitados como recipiente. No recomiendo utilizar un matraz, ya que el flujo de oxígeno en el interior será difícil debido al cuello estrecho del matraz.
Antes de realizar este experimento, le recomiendo encarecidamente que se familiarice con las precauciones de seguridad al trabajar con ácidos.
Vierta una cucharadita de vitriolo en un frasco y agregue 40 ml de ácido. La solución se vuelve verde debido a la formación del complejo tetraclorocuprato de iones de cobre [CuCl4]2-.
Ahora solo queda agregar el papel de aluminio. Está cubierto con una película de óxido, pero el complejo resultante lo destruye rápidamente. Luego parte del aluminio reacciona con el ácido, la ecuación para esta reacción es:
Como puede verse en la reacción, se libera hidrógeno.
El resto del aluminio interactúa con el complejo, desplazando al cobre:
Las reacciones ocurren rápidamente y liberan grandes cantidades de calor.
El hidrógeno liberado arde bien en el aire, prendámosle fuego.
El estrecho flujo de la llama está asociado con las características del cuello del frasco, y el rico color azul se lo dan los iones de cobre que están presentes en la solución.
Hagamos el mismo experimento, pero en un contenedor diferente:
Cuando todo el aluminio ha reaccionado, la solución se vuelve gris con manchas de cobre reducido en la superficie. Se debe diluir con abundante agua y verter por el desagüe.
Quedan sedimentos en el fondo:
También conviene deshacerse de él, ya que después de intentar filtrar, quedó un precipitado de color marrón claro en el filtro, que no se puede llamar cobre.
Y esto concluye este artículo. Esta experiencia se puede demostrar en las lecciones de química en la escuela. ¡Buena suerte con vuestra repetición a todos!
Su esencia es que el hidrógeno liberado durante la reacción arde con una llama azul.
reactivos
Entonces, necesitaremos:
- Concentración de ácido clorhídrico 15%;
- Sulfato de cobre;
- Papel de aluminio.
Realizaremos el experimento en un frasco de vidrio.
Puedes utilizar una placa de Petri o un vaso de precipitados como recipiente. No recomiendo utilizar un matraz, ya que el flujo de oxígeno en el interior será difícil debido al cuello estrecho del matraz.
Experimento
Antes de realizar este experimento, le recomiendo encarecidamente que se familiarice con las precauciones de seguridad al trabajar con ácidos.
Vierta una cucharadita de vitriolo en un frasco y agregue 40 ml de ácido. La solución se vuelve verde debido a la formación del complejo tetraclorocuprato de iones de cobre [CuCl4]2-.
Ahora solo queda agregar el papel de aluminio. Está cubierto con una película de óxido, pero el complejo resultante lo destruye rápidamente. Luego parte del aluminio reacciona con el ácido, la ecuación para esta reacción es:
Como puede verse en la reacción, se libera hidrógeno.
El resto del aluminio interactúa con el complejo, desplazando al cobre:
Las reacciones ocurren rápidamente y liberan grandes cantidades de calor.
El hidrógeno liberado arde bien en el aire, prendámosle fuego.
El estrecho flujo de la llama está asociado con las características del cuello del frasco, y el rico color azul se lo dan los iones de cobre que están presentes en la solución.
Hagamos el mismo experimento, pero en un contenedor diferente:
Cuando todo el aluminio ha reaccionado, la solución se vuelve gris con manchas de cobre reducido en la superficie. Se debe diluir con abundante agua y verter por el desagüe.
Quedan sedimentos en el fondo:
También conviene deshacerse de él, ya que después de intentar filtrar, quedó un precipitado de color marrón claro en el filtro, que no se puede llamar cobre.
Conclusión
Y esto concluye este artículo. Esta experiencia se puede demostrar en las lecciones de química en la escuela. ¡Buena suerte con vuestra repetición a todos!
Clases magistrales similares
Particularmente interesante
Comentarios (2)