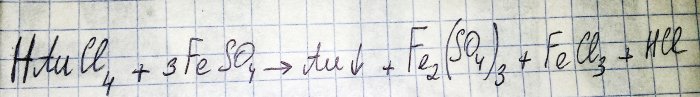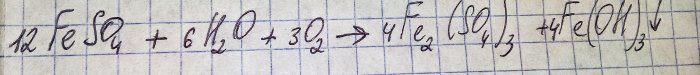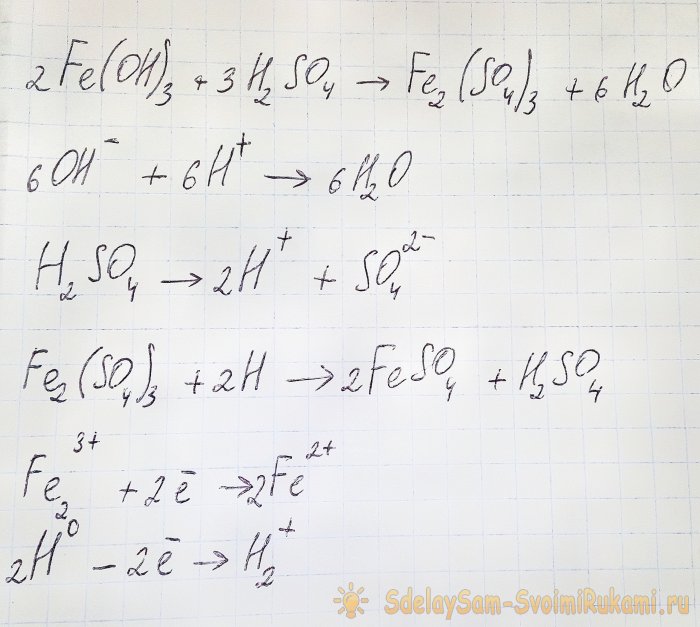Una forma rápida de obtener sulfato ferroso a partir de fertilizantes.
El penúltimo paso en el camino hacia la obtención de un metal noble a partir de componentes de radio es la reducción de este último a partir del cloruro correspondiente. El sulfato de hierro (II) es excelente para estos fines. Considere la ecuación para esta reacción:
HAuCl4 - tetracloroaurato de hidrógeno (III): un compuesto que se forma cuando el oro se disuelve en agua regia. No profundizaremos por ahora en este proceso, ya que merece un artículo aparte.
Por tanto, el sulfato (en adelante, sulfato de hierro (II)) es uno de los agentes reductores baratos y fácilmente disponibles. En las tiendas se puede encontrar con el nombre de “sulfato de hierro”, es un fertilizante. Pero esta no es una sustancia pura, la proporción de sulfato que contiene es aproximadamente del 50%, el resto son impurezas. Y antes de que podamos restaurar el oro, necesitamos purificar nuestro sulfato.
Necesitará
Para esto necesitarás:
- sulfato de hierro (se vende en tiendas como “todo para el jardín”; compré un kilogramo para tener suficiente para mi cabeza);
- Solución de ácido sulfúrico, también conocida como electrolito ácido para baterías (en concesionarios de automóviles);
- Alcohol, usé 95%;
- Vajilla química o desechable (vasos, cucharas para revolver).
Obtenemos sulfato de hierro a partir de fertilizantes.
Utilizo un frasco de vidrio para preparar la solución. En su interior hay 500 ml de agua caliente, quizá un poco menos.
Ahora mida aproximadamente medio vaso de fertilizante:
Como puede ver, la sustancia tiene un color marrón amarillento; este "sulfato" sucio solo se puede usar para el propósito previsto: rociar la vegetación. Tenemos otros objetivos.
Viértelo en el frasco:
La solución adquirió un desagradable color marrón. La coloración se produjo debido a la reacción del fertilizante con el agua:
El hierro en sulfato se oxida a trivalente y el hidróxido de hierro (III) precipita, lo que en realidad es la razón de su color.
Para obtener a partir de los compuestos resultantes el sulfato que nos interesa es necesario acidificar la solución con ácido sulfúrico. Agregue en porciones pequeñas hasta que la solución se aclare.
En este caso, ocurren las siguientes reacciones:
El hidróxido reacciona con el ácido para formar sulfato de hierro (III) (reacción de intercambio iónico). A su vez reacciona con el hidrógeno atómico, que se forma durante la disociación del ácido sulfúrico. La última reacción es redox.
Ahora la solución contiene exactamente el sulfato que necesitamos, pero la solución en sí todavía está turbia. Déjalo reposar y fíltralo, yo usé un filtro químico.
En el fondo del frasco quedaron impurezas insolubles:
Lo enjuagamos y vertemos en él la solución filtrada. Es mucho más ligero y limpio que el original.
El alcohol etílico desplaza las sales de ácidos dibásicos de sus soluciones. Usaremos esta propiedad para obtener sulfato sólido. Agregamos alcohol a la solución, vertí 200 ml, que es igual en volumen a un poco más de la mitad del volumen original de fertilizante.
En el fondo aparecieron cristales de nuestro sulfato.
Dejé la solución durante dos días para que todo el sulfato tuviera tiempo de precipitar.
Inicialmente puedes agregar más alcohol para acelerar este proceso.
Escurrir el líquido, dando golpecitos en el fondo y calentando suavemente, separar el sulfato del frasco y verterlo sobre una toalla de papel para que se seque.
Después de unas horas, vierta el sulfato en un frasco de vidrio, etiquete la sustancia y de esta forma se podrá almacenar durante mucho tiempo.
Dado que precipitaron hidratos cristalinos, la fórmula de la sustancia es la que se muestra en la imagen. Pero esto no nos impide utilizarlo para nuestros propios fines, disolviéndolo en agua de todos modos.
Conclusión
Las precauciones de seguridad y el cumplimiento de las normas para el manejo de ácidos son un hecho. Bajo ninguna circunstancia debemos olvidarnos de ellos.
¡Sustancias limpias para todos!
Clases magistrales similares
Particularmente interesante
Comentarios (1)