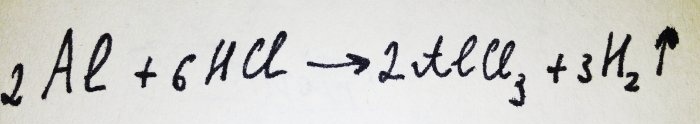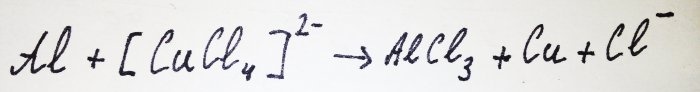Yksinkertainen kokeilu - Sininen liekki
Hyvää päivää, uteliaat kemistit! Tänään teemme yksinkertaisen mutta näyttävän kokeen.
Sen ydin on, että reaktion aikana vapautuva vety palaa sinisellä liekillä.
Tarvitsemme siis:
Suoritamme kokeen lasipurkissa.
Astiana voit käyttää petrimaljaa tai dekantterilasia. En suosittele pullon käyttöä, koska hapen virtaus sisällä on vaikeaa pullon kapean kaulan vuoksi.
Ennen tämän kokeen suorittamista suosittelen, että tutustut turvatoimiin happojen kanssa työskennellessäsi.
Kaada teelusikallinen vitriolia purkkiin ja lisää 40 ml happoa. Liuos muuttuu vihreäksi kompleksisen kupari-ionitetrakloorikupraatti [CuCl4]2- muodostumisen vuoksi.
Nyt jäljellä on vain lisätä alumiinifolio. Se on peitetty oksidikalvolla, mutta tuloksena oleva kompleksi tuhoaa sen nopeasti. Sitten osa alumiinista reagoi hapon kanssa, tämän reaktion yhtälö on:
Kuten reaktiosta voidaan nähdä, vetyä vapautuu.
Loput alumiinista on vuorovaikutuksessa kompleksin kanssa ja syrjäyttää kuparin siitä:
Reaktiot tapahtuvat nopeasti, jolloin vapautuu suuria määriä lämpöä.
Vapautunut vety palaa hyvin ilmassa, sytytetään se tuleen.
Kapea liekkivirtaus liittyy purkin kaulan ominaisuuksiin, ja täyteläisen sinisen värin antavat sille liuoksessa olevat kupari-ionit.
Tehdään sama kokeilu, mutta eri säilössä:
Kun kaikki alumiini on reagoinut, liuos muuttuu harmaaksi ja pinnalla on pilkkuja kuparia. Se on laimennettava runsaalla vedellä ja kaadettava viemäriin.
Pohjalle on jäänyt sedimenttiä:
Siitä pitäisi myös päästä eroon, sillä suodatusyrityksen jälkeen suodattimeen jäi vaaleanruskea sakka, jota ei voida kutsua kupariksi.
Ja tähän tämä artikkeli päättyy. Tämä kokemus voidaan osoittaa koulun kemian tunneilla. Onnea toistoon kaikille!
Sen ydin on, että reaktion aikana vapautuva vety palaa sinisellä liekillä.
Reagenssit
Tarvitsemme siis:
- Kloorivetyhappopitoisuus 15 %;
- Kuparisulfaatti;
- Alumiinifolio.
Suoritamme kokeen lasipurkissa.
Astiana voit käyttää petrimaljaa tai dekantterilasia. En suosittele pullon käyttöä, koska hapen virtaus sisällä on vaikeaa pullon kapean kaulan vuoksi.
Koe
Ennen tämän kokeen suorittamista suosittelen, että tutustut turvatoimiin happojen kanssa työskennellessäsi.
Kaada teelusikallinen vitriolia purkkiin ja lisää 40 ml happoa. Liuos muuttuu vihreäksi kompleksisen kupari-ionitetrakloorikupraatti [CuCl4]2- muodostumisen vuoksi.
Nyt jäljellä on vain lisätä alumiinifolio. Se on peitetty oksidikalvolla, mutta tuloksena oleva kompleksi tuhoaa sen nopeasti. Sitten osa alumiinista reagoi hapon kanssa, tämän reaktion yhtälö on:
Kuten reaktiosta voidaan nähdä, vetyä vapautuu.
Loput alumiinista on vuorovaikutuksessa kompleksin kanssa ja syrjäyttää kuparin siitä:
Reaktiot tapahtuvat nopeasti, jolloin vapautuu suuria määriä lämpöä.
Vapautunut vety palaa hyvin ilmassa, sytytetään se tuleen.
Kapea liekkivirtaus liittyy purkin kaulan ominaisuuksiin, ja täyteläisen sinisen värin antavat sille liuoksessa olevat kupari-ionit.
Tehdään sama kokeilu, mutta eri säilössä:
Kun kaikki alumiini on reagoinut, liuos muuttuu harmaaksi ja pinnalla on pilkkuja kuparia. Se on laimennettava runsaalla vedellä ja kaadettava viemäriin.
Pohjalle on jäänyt sedimenttiä:
Siitä pitäisi myös päästä eroon, sillä suodatusyrityksen jälkeen suodattimeen jäi vaaleanruskea sakka, jota ei voida kutsua kupariksi.
Johtopäätös
Ja tähän tämä artikkeli päättyy. Tämä kokemus voidaan osoittaa koulun kemian tunneilla. Onnea toistoon kaikille!
Samanlaisia mestarikursseja
Erityisen mielenkiintoista
Kommentit (2)