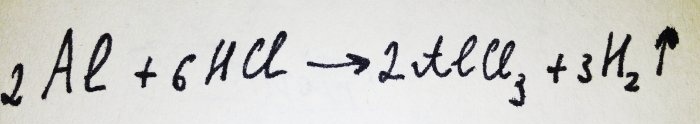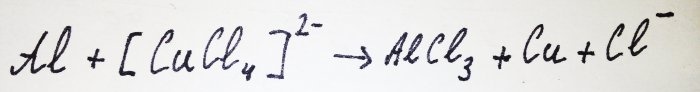Une expérience simple - Flamme bleue
Bonjour, chimistes curieux ! Aujourd'hui, nous allons mener une expérience simple mais spectaculaire.
Son essence est que l'hydrogène libéré lors de la réaction brûle avec une flamme bleue.
Nous aurons donc besoin de :
Nous réaliserons l'expérience dans un bocal en verre.
Vous pouvez utiliser une boîte de Pétri ou un bécher comme récipient. Je ne recommande pas d'utiliser un flacon, car la circulation de l'oxygène à l'intérieur sera difficile en raison du col étroit du flacon.
Avant de réaliser cette expérience, je vous recommande fortement de vous familiariser avec les précautions de sécurité lorsque vous travaillez avec des acides.
Versez une cuillère à café de vitriol dans un pot et ajoutez 40 ml d'acide. La solution devient verte en raison de la formation d’un complexe tétrachlorocuprate d’ions cuivre [CuCl4]2-.
Il ne reste plus qu'à ajouter la feuille d'aluminium. Il est recouvert d'un film d'oxyde, mais le complexe qui en résulte le détruit rapidement. Ensuite, une partie de l’aluminium réagit avec l’acide, l’équation de cette réaction est :
Comme le montre la réaction, de l’hydrogène est libéré.
Le reste de l'aluminium interagit avec le complexe, en déplaçant le cuivre :
Les réactions se produisent rapidement, libérant de grandes quantités de chaleur.
L'hydrogène libéré brûle bien dans l'air, y mettons le feu.
Le flux étroit de la flamme est associé aux caractéristiques du col du pot et la riche couleur bleue lui est donnée par les ions de cuivre présents dans la solution.
Faisons la même expérience, mais dans un conteneur différent :
Lorsque tout l’aluminium a réagi, la solution devient grise avec des taches de cuivre réduit en surface. Il doit être dilué avec beaucoup d’eau et versé dans les égouts.
Il reste des sédiments au fond :
Vous devez également vous en débarrasser, car après avoir essayé de filtrer, un précipité brun clair est resté sur le filtre et on ne peut pas l'appeler cuivre.
Et ceci conclut cet article. Cette expérience peut être démontrée dans les cours de chimie à l’école. Bonne chance à tous pour votre répétition !
Son essence est que l'hydrogène libéré lors de la réaction brûle avec une flamme bleue.
Réactifs
Nous aurons donc besoin de :
- Concentration d'acide chlorhydrique 15 % ;
- Sulfate de cuivre;
- Papier d'aluminium.
Nous réaliserons l'expérience dans un bocal en verre.
Vous pouvez utiliser une boîte de Pétri ou un bécher comme récipient. Je ne recommande pas d'utiliser un flacon, car la circulation de l'oxygène à l'intérieur sera difficile en raison du col étroit du flacon.
Expérience
Avant de réaliser cette expérience, je vous recommande fortement de vous familiariser avec les précautions de sécurité lorsque vous travaillez avec des acides.
Versez une cuillère à café de vitriol dans un pot et ajoutez 40 ml d'acide. La solution devient verte en raison de la formation d’un complexe tétrachlorocuprate d’ions cuivre [CuCl4]2-.
Il ne reste plus qu'à ajouter la feuille d'aluminium. Il est recouvert d'un film d'oxyde, mais le complexe qui en résulte le détruit rapidement. Ensuite, une partie de l’aluminium réagit avec l’acide, l’équation de cette réaction est :
Comme le montre la réaction, de l’hydrogène est libéré.
Le reste de l'aluminium interagit avec le complexe, en déplaçant le cuivre :
Les réactions se produisent rapidement, libérant de grandes quantités de chaleur.
L'hydrogène libéré brûle bien dans l'air, y mettons le feu.
Le flux étroit de la flamme est associé aux caractéristiques du col du pot et la riche couleur bleue lui est donnée par les ions de cuivre présents dans la solution.
Faisons la même expérience, mais dans un conteneur différent :
Lorsque tout l’aluminium a réagi, la solution devient grise avec des taches de cuivre réduit en surface. Il doit être dilué avec beaucoup d’eau et versé dans les égouts.
Il reste des sédiments au fond :
Vous devez également vous en débarrasser, car après avoir essayé de filtrer, un précipité brun clair est resté sur le filtre et on ne peut pas l'appeler cuivre.
Conclusion
Et ceci conclut cet article. Cette expérience peut être démontrée dans les cours de chimie à l’école. Bonne chance à tous pour votre répétition !
Classes de maître similaires
Particulièrement intéressant
Commentaires (2)