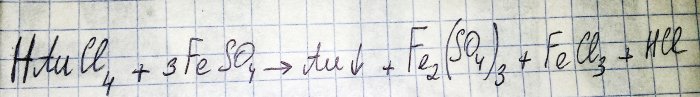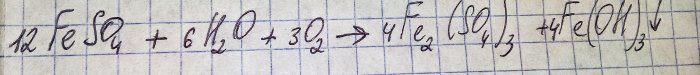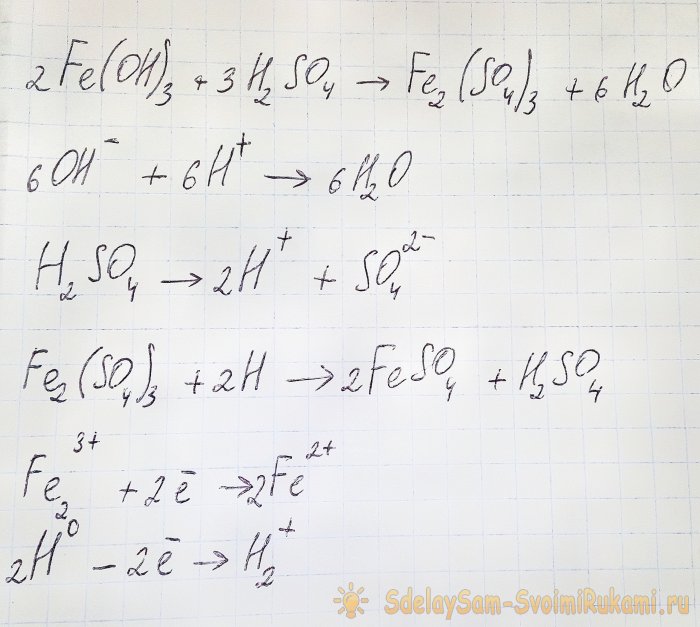A vas-szulfát műtrágyából történő kinyerésének gyors módja
Az utolsó előtti lépés a nemesfém rádióalkatrészekből történő előállításához az utóbbi redukciója a megfelelő kloridból. A vas(II)-szulfát kiválóan alkalmas erre a célra. Tekintsük ennek a reakciónak az egyenletét:
HAuCl4 - hidrogén-tetraklór-aurát (III) - egy vegyület, amely akkor képződik, amikor az aranyat feloldják a vízben. Egyelőre nem megyünk bele ebbe a folyamatba, mert külön cikket érdemel.
Tehát a szulfát (a továbbiakban vas(II)-szulfát) az egyik olcsó és könnyen beszerezhető redukálószer. Az üzletekben „vas-szulfát” néven megtalálható, műtrágya. De ez nem tiszta anyag, a szulfát aránya körülbelül 50%, a többi szennyeződés. És mielőtt visszaállíthatnánk az aranyat, meg kell tisztítanunk a szulfátunkat.
Szükség lesz
Ehhez szüksége lesz:
- Vas-szulfát (a boltokban árulják, mint „mindent a kertbe”; vettem egy kilogrammot, hogy elég legyen a fejemnek);
- Kénsav oldat, más néven savas elektrolit akkumulátorokhoz (autókereskedésekben);
- Alkohol, 95%-ot használtam;
- Vegyszeres vagy eldobható edények (csészék, keverőkanál).
A vas-szulfátot műtrágyából nyerjük
Az oldat elkészítéséhez üvegedényt használok. 500 ml forró víz van benne, talán kicsit kevesebb.
Most mérjünk ki körülbelül fél pohár műtrágyát:
Mint látható, az anyag sárga-barna színű, az ilyen piszkos „szulfát” csak a rendeltetésszerű célra használható - a növényzet permetezésére. Más céljaink vannak.
Öntse az üvegbe:
Az oldat kellemetlen barna színűvé vált. Az elszíneződés a műtrágya vízzel való reakciója miatt következett be:
A szulfátban lévő vas háromértékűvé oxidálódik, és a vas(III)-hidroxid kicsapódik, ami tulajdonképpen a színének az oka.
Ahhoz, hogy a keletkező vegyületekből az általunk érdekelt szulfátot kapjuk, az oldatot kénsavval kell savanyítani. Kis adagokban adjuk hozzá, amíg az oldat megvilágosodik.
Ebben az esetben a következő reakciók fordulnak elő:
A hidroxid a savval reagálva vas(III)-szulfátot képez (ioncserélő reakció). Ez viszont reakcióba lép az atomos hidrogénnel, amely a kénsav disszociációja során keletkezik. Az utolsó reakció a redox.
Most az oldat pontosan azt a szulfátot tartalmazza, amire szükségünk van, de maga az oldat továbbra is zavaros. Hagyjuk ülni és szűrjük le, én vegyi szűrőt használtam.
Az edény alján oldhatatlan szennyeződések maradtak:
Leöblítjük és beleöntjük a leszűrt oldatot. Sokkal könnyebb és tisztább, mint az eredeti.
Az etil-alkohol kiszorítja a kétbázisú savak sóit oldataikból. Ezt a tulajdonságot használjuk fel szilárd szulfát előállítására. Az oldathoz alkoholt adunk, 200 ml-t öntöttem, ami térfogatban megegyezik az eredeti műtrágya térfogatának valamivel több mint felével.
Alul a szulfátunk kristályai jelentek meg.
Az oldatot két napig hagytam, hogy az összes szulfátnak legyen ideje kicsapódni.
Kezdetben több alkoholt adhat hozzá, hogy felgyorsítsa ezt a folyamatot.
Engedje le a folyadékot az aljára ütögetve és enyhe melegítéssel, válassza le a szulfátot az üvegből, és öntse papírtörlőre, hogy megszáradjon.
Néhány óra elteltével öntse a szulfátot egy üvegedénybe, címkézze fel az anyagot, és ebben a formában sokáig eltartható.
Mivel kristályos hidrátok váltak ki, az anyag képlete a képen látható. De ez nem akadályoz meg abban, hogy saját célra használjuk, úgyis vízben oldjuk.
Következtetés
A biztonsági óvintézkedések és a savak kezelésére vonatkozó szabályok betartása adott. Semmi esetre sem szabad megfeledkeznünk róluk.
Tiszta anyagokat mindenkinek!
Hasonló mesterkurzusok
Különösen érdekes
Megjegyzések (1)