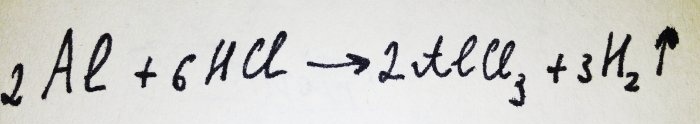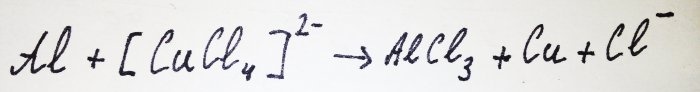Vienkāršs eksperiments - Zilā liesma
Laba diena, zinātkārie ķīmiķi! Šodien mēs veiksim vienkāršu, bet iespaidīgu eksperimentu.
Tās būtība ir tāda, ka reakcijas laikā izdalītais ūdeņradis deg ar zilu liesmu.
Tātad, mums būs nepieciešams:
Mēs veiksim eksperimentu stikla burkā.
Kā trauku varat izmantot Petri trauciņu vai vārglāzi. Es neiesaku izmantot kolbu, jo skābekļa plūsma iekšpusē būs apgrūtināta kolbas šaurā kakla dēļ.
Pirms šī eksperimenta veikšanas es ļoti iesaku iepazīties ar drošības pasākumiem, strādājot ar skābēm.
Ielejiet burkā tējkaroti vitriola un pievienojiet 40 ml skābes. Šķīdums kļūst zaļš, jo veidojas komplekss vara jonu tetrahlorokuprāts [CuCl4]2-.
Tagad atliek tikai pievienot alumīnija foliju. Tas ir pārklāts ar oksīda plēvi, bet iegūtais komplekss to ātri iznīcina. Tad daļa alumīnija reaģē ar skābi, šīs reakcijas vienādojums ir:
Kā redzams no reakcijas, izdalās ūdeņradis.
Pārējais alumīnijs mijiedarbojas ar kompleksu, izspiežot no tā varu:
Reakcijas notiek ātri, izdalot lielu daudzumu siltuma.
Izdalītais ūdeņradis labi sadeg gaisā, aizdedzināsim.
Šaurā liesmas plūsma ir saistīta ar burkas kakliņa īpašībām, un piesātināto zilo krāsu tai piešķir vara joni, kas atrodas šķīdumā.
Veiksim to pašu eksperimentu, bet citā konteinerā:
Kad viss alumīnijs ir reaģējis, šķīdums kļūst pelēks ar samazināta vara plankumiem uz virsmas. Tas jāatšķaida ar lielu daudzumu ūdens un jāizlej kanalizācijā.
Apakšā ir palikuši nogulumi:
No tā arī vajadzētu atbrīvoties, jo pēc filtrēšanas uz filtra palika gaiši brūnas nogulsnes, un tās nevar saukt par varu.
Un tas noslēdz šo rakstu. Šo pieredzi var demonstrēt ķīmijas stundās skolā. Lai visiem veicas atkārtošanā!
Tās būtība ir tāda, ka reakcijas laikā izdalītais ūdeņradis deg ar zilu liesmu.
Reaģenti
Tātad, mums būs nepieciešams:
- Sālsskābes koncentrācija 15%;
- Vara sulfāts;
- Alumīnija folija.
Mēs veiksim eksperimentu stikla burkā.
Kā trauku varat izmantot Petri trauciņu vai vārglāzi. Es neiesaku izmantot kolbu, jo skābekļa plūsma iekšpusē būs apgrūtināta kolbas šaurā kakla dēļ.
Eksperimentējiet
Pirms šī eksperimenta veikšanas es ļoti iesaku iepazīties ar drošības pasākumiem, strādājot ar skābēm.
Ielejiet burkā tējkaroti vitriola un pievienojiet 40 ml skābes. Šķīdums kļūst zaļš, jo veidojas komplekss vara jonu tetrahlorokuprāts [CuCl4]2-.
Tagad atliek tikai pievienot alumīnija foliju. Tas ir pārklāts ar oksīda plēvi, bet iegūtais komplekss to ātri iznīcina. Tad daļa alumīnija reaģē ar skābi, šīs reakcijas vienādojums ir:
Kā redzams no reakcijas, izdalās ūdeņradis.
Pārējais alumīnijs mijiedarbojas ar kompleksu, izspiežot no tā varu:
Reakcijas notiek ātri, izdalot lielu daudzumu siltuma.
Izdalītais ūdeņradis labi sadeg gaisā, aizdedzināsim.
Šaurā liesmas plūsma ir saistīta ar burkas kakliņa īpašībām, un piesātināto zilo krāsu tai piešķir vara joni, kas atrodas šķīdumā.
Veiksim to pašu eksperimentu, bet citā konteinerā:
Kad viss alumīnijs ir reaģējis, šķīdums kļūst pelēks ar samazināta vara plankumiem uz virsmas. Tas jāatšķaida ar lielu daudzumu ūdens un jāizlej kanalizācijā.
Apakšā ir palikuši nogulumi:
No tā arī vajadzētu atbrīvoties, jo pēc filtrēšanas uz filtra palika gaiši brūnas nogulsnes, un tās nevar saukt par varu.
Secinājums
Un tas noslēdz šo rakstu. Šo pieredzi var demonstrēt ķīmijas stundās skolā. Lai visiem veicas atkārtošanā!
Līdzīgas meistarklases
Īpaši interesanti
Komentāri (2)