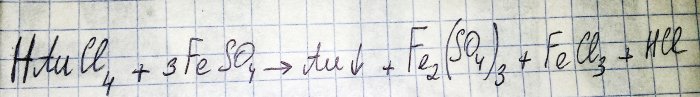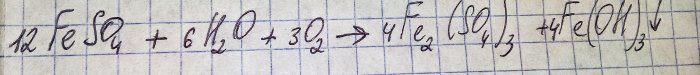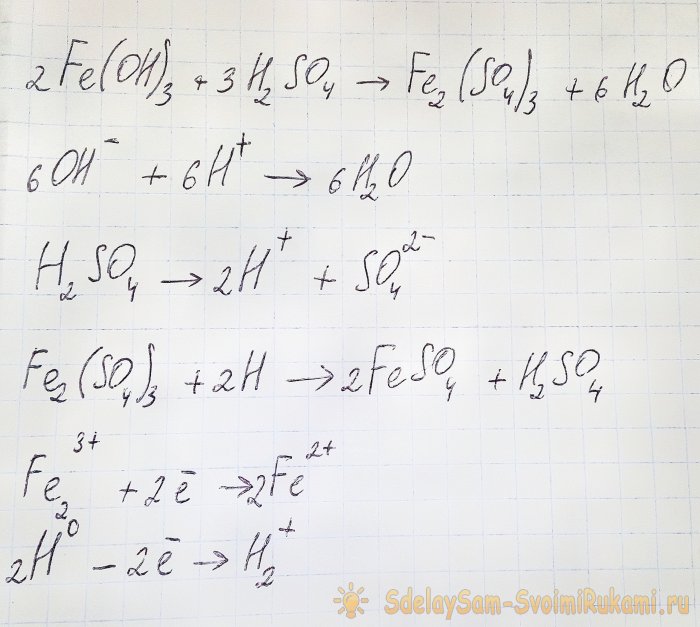Uma maneira rápida de obter sulfato ferroso a partir de fertilizantes
O penúltimo passo no caminho para a obtenção de um metal nobre a partir de componentes de rádio é a redução deste último do cloreto correspondente. O sulfato de ferro (II) é excelente para esses fins. Considere a equação para esta reação:
HAuCl4 - tetracloroaurato de hidrogênio (III) - composto que se forma quando o ouro é dissolvido em água régia. Não iremos nos aprofundar nesse processo por enquanto, pois ele merece um artigo à parte.
Portanto, o sulfato (doravante denominado sulfato de ferro (II)) é um dos agentes redutores baratos e facilmente disponíveis. Nas lojas pode ser encontrado com o nome de “sulfato de ferro”, é um fertilizante. Mas esta não é uma substância pura, a proporção de sulfato nela é de cerca de 50%, o resto são impurezas. E antes de podermos restaurar o ouro, precisamos purificar o nosso sulfato.
Vai precisar
Para isso você precisará de:
- Sulfato de ferro (vendido em lojas como “tudo para jardim”; comprei um quilo para ter o suficiente para a cabeça);
- Solução de ácido sulfúrico, também conhecido como eletrólito ácido para baterias (em concessionárias);
- Álcool, usei 95%;
- Talheres químicos ou descartáveis (xícaras, colheres para mexer).
Obtemos sulfato de ferro a partir de fertilizantes
Eu uso uma jarra de vidro para preparar a solução. Lá dentro tem 500 ml de água quente, talvez um pouco menos.
Agora meça cerca de meio copo de fertilizante:
Como você pode ver, a substância é de cor amarelo-marrom, esse “sulfato” sujo só pode ser usado para o fim a que se destina - para pulverizar a vegetação. Temos outros objetivos.
Despeje na jarra:
A solução adquiriu uma cor marrom desagradável. A coloração ocorreu devido à reação do fertilizante com a água:
O ferro no sulfato é oxidado a trivalente e o hidróxido de ferro (III) precipita, o que na verdade é a razão de sua cor.
Para obter o sulfato que nos interessa a partir dos compostos resultantes, é necessário acidificar a solução com ácido sulfúrico. Adicione em pequenas porções até a solução clarear.
Neste caso, ocorrem as seguintes reações:
O hidróxido reage com o ácido para formar sulfato de ferro (III) (reação de troca iônica). Por sua vez, reage com o hidrogênio atômico, que se forma durante a dissociação do ácido sulfúrico. A última reação é redox.
Agora a solução contém exatamente o sulfato que precisamos, mas a solução em si ainda está turva. Deixe descansar e filtre, usei um filtro químico.
Impurezas insolúveis permaneceram no fundo do frasco:
Lavamos e colocamos a solução filtrada nele. É muito mais leve e limpo que o original.
O álcool etílico desloca os sais dos ácidos dibásicos de suas soluções. Usaremos esta propriedade para obter sulfato sólido. Colocamos álcool na solução, despejei 200 ml, que equivale em volume a pouco mais da metade do volume original do fertilizante.
Cristais do nosso sulfato apareceram no fundo.
Deixei a solução por dois dias para que todo o sulfato tivesse tempo de precipitar.
Você pode inicialmente adicionar mais álcool para tornar esse processo mais rápido.
Escorra o líquido, batendo no fundo e aquecendo suavemente, separe o sulfato do pote e despeje sobre papel toalha para secar.
Depois de algumas horas, despeje o sulfato em uma jarra de vidro, rotule a substância, e desta forma ela pode ser armazenada por muito tempo.
Como os hidratos cristalinos precipitaram, a fórmula da substância é como na imagem. Mas isso não nos impede de utilizá-lo para nossos próprios fins, dissolvendo-o de qualquer maneira na água.
Conclusão
As precauções de segurança e o cumprimento das regras para o manuseio de ácidos são um dado adquirido. Sob nenhuma circunstância devemos esquecê-los.
Substâncias limpas para todos!
Master classes semelhantes
Particularmente interessante
Comentários (1)