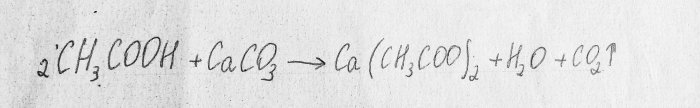Alcool sec DIY
C'est ce dont nous parlerons dans cet article. Je constate que cette substance n’a qu’un nom commun avec l’alcool – nous le verrons plus tard. Maintenant, cuisinons-le !
Aura besoin
Comme réactifs chimiques, nous utiliserons ce que l’on trouve facilement dans les rayons.
Ainsi, pour préparer de l'alcool solide il nous faut :
- Acide acétique 70 %, vendu en épicerie ;
- Craie naturelle - dans les magasins de jardinage ;
- Alcool médical à 95 % ou alcool isopropylique - respectivement en pharmacie ou chez un concessionnaire automobile.
Nous aurons également besoin d'eau et de verrerie jetable (ou chimique) pour l'expérience elle-même, ainsi que de gants en caoutchouc. En aucun cas, l’un des éléments ci-dessus ne doit être utilisé comme aliment une fois les expériences terminées !
Vous pouvez utiliser un gobelet en plastique de 200 ml comme verre doseur.
Commençons par faire de l'alcool sec
Versez d’abord 60 ml d’acide acétique et 125 ml d’eau dans le ballon.
Ajoutez maintenant de la craie à la solution obtenue par petites portions. Des bulles de gaz commencent à apparaître et il est important de remuer constamment la solution pour qu'elles aient le temps d'éclater.
La consommation totale de craie sera de 42 grammes, mais elle devra être ajoutée jusqu'à ce qu'elle cesse de se dissoudre.
Considérons la réaction chimique du processus :
Il s'agit d'une réaction de neutralisation.
La première substance est l'acide acétique. Le second est le carbonate de calcium, contenu dans la craie. Le résultat de cette réaction est du dioxyde de carbone, de l'eau et de l'acétate de calcium. Cette substance est peu soluble dans l'eau, donc pendant l'expérience la solution peut durcir sous vos yeux :Dans ce cas, vous devez ajouter un peu d'eau et poursuivre l'expérience.
Lorsqu’il n’y a plus d’acide dans la solution, la réaction s’arrête. Laissons-le s'installer.
Après un certain temps, l'excès de craie se déposera au fond, car elle est elle-même insoluble dans l'eau. Filtrez maintenant la solution :J'ai utilisé un filtre en papier, vous pouvez également utiliser un coton.
La solution filtrée a une teinte jaunâtre, c'est une solution plus ou moins pure d'acétate de calcium. Versez une petite quantité dans un autre récipient et ajoutez un peu d'alcool. Une masse gélatineuse commence à se former :
Ou une teinte plus claire :
Félicitations, nous avons de l'alcool solide ! En effet, l'acétate de calcium, en raison de la présence de l'alcool que nous avons ajouté, a commencé à précipiter sous forme de monohydrate ; car l'alcool tend à déplacer les sels des métaux divalents de la solution, ce que nous observons.
Maintenant, avec nos mains (toujours avec des gants !), nous donnons à notre gelée la forme d'un cube ou d'une boule.
À une température de 160 degrés Celsius, l'acétate de calcium se décompose notamment en substances inflammables qui favorisent une décomposition ultérieure et entretiennent la flamme.
Un morceau de cette taille peut brûler jusqu'à six minutes, ce qui est un très bon résultat. Et deux pièces suffisent pour préparer du thé pour une personne. À la suite de l'expérience, une quantité suffisante d'acétate de calcium a été obtenue, ce qui signifie qu'elle durera longtemps.
Conclusion
Après production, nous plaçons l'alcool solide de la forme souhaitée dans un récipient hermétiquement fermé et n'hésitez pas à l'emporter avec nous en randonnée. Et ceci conclut cet article. Bonne randonnée à tous !
P.S. Vous pouvez également faire pousser des cristaux incolores en forme d’aiguilles à partir d’acétate de calcium, mais c’est une toute autre histoire…