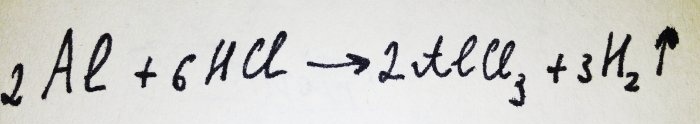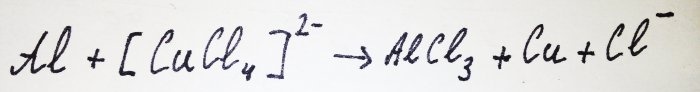Un semplice esperimento: fiamma blu
Buona giornata, chimici curiosi! Oggi condurremo un esperimento semplice ma spettacolare.
La sua essenza è che l'idrogeno rilasciato durante la reazione brucia con una fiamma blu.
Quindi, avremo bisogno di:
Condurremo l'esperimento in un barattolo di vetro.
Puoi usare una capsula Petri o un bicchiere come recipiente. Non consiglio l'uso di una beuta, poiché il flusso di ossigeno all'interno sarà difficile a causa del collo stretto della beuta.
Prima di condurre questo esperimento, ti consiglio vivamente di familiarizzare con le precauzioni di sicurezza quando lavori con gli acidi.
Versare un cucchiaino di vetriolo in un barattolo e aggiungere 40 ml di acido. La soluzione diventa verde a causa della formazione del complesso ione rame tetraclorocuprato [CuCl4]2-.
Ora non resta che aggiungere il foglio di alluminio. È ricoperto da una pellicola di ossido, ma il complesso risultante lo distrugge rapidamente. Quindi parte dell'alluminio reagisce con l'acido, l'equazione per questa reazione è:
Come si può vedere dalla reazione, viene rilasciato idrogeno.
Il resto dell'alluminio interagisce con il complesso, spostando da esso il rame:
Le reazioni avvengono rapidamente, rilasciando grandi quantità di calore.
L'idrogeno rilasciato brucia bene nell'aria, diamo fuoco.
Il flusso stretto della fiamma è associato alle caratteristiche del collo del vaso, e il colore blu intenso gli è conferito dagli ioni rame presenti nella soluzione.
Facciamo lo stesso esperimento, ma in un contenitore diverso:
Quando tutto l'alluminio ha reagito, la soluzione diventa grigia con macchie di rame ridotto sulla superficie. Dovrebbe essere diluito con abbondante acqua e versato nello scarico.
Sul fondo è rimasto del sedimento:
Dovresti anche sbarazzartene, poiché dopo aver provato a filtrare, sul filtro è rimasto un precipitato marrone chiaro e non può essere chiamato rame.
E questo conclude questo articolo. Questa esperienza può essere dimostrata nelle lezioni di chimica a scuola. Buona fortuna a tutti con la vostra ripetizione!
La sua essenza è che l'idrogeno rilasciato durante la reazione brucia con una fiamma blu.
Reagenti
Quindi, avremo bisogno di:
- Concentrazione di acido cloridrico 15%;
- Solfato di rame;
- Foglio di alluminio.
Condurremo l'esperimento in un barattolo di vetro.
Puoi usare una capsula Petri o un bicchiere come recipiente. Non consiglio l'uso di una beuta, poiché il flusso di ossigeno all'interno sarà difficile a causa del collo stretto della beuta.
Sperimentare
Prima di condurre questo esperimento, ti consiglio vivamente di familiarizzare con le precauzioni di sicurezza quando lavori con gli acidi.
Versare un cucchiaino di vetriolo in un barattolo e aggiungere 40 ml di acido. La soluzione diventa verde a causa della formazione del complesso ione rame tetraclorocuprato [CuCl4]2-.
Ora non resta che aggiungere il foglio di alluminio. È ricoperto da una pellicola di ossido, ma il complesso risultante lo distrugge rapidamente. Quindi parte dell'alluminio reagisce con l'acido, l'equazione per questa reazione è:
Come si può vedere dalla reazione, viene rilasciato idrogeno.
Il resto dell'alluminio interagisce con il complesso, spostando da esso il rame:
Le reazioni avvengono rapidamente, rilasciando grandi quantità di calore.
L'idrogeno rilasciato brucia bene nell'aria, diamo fuoco.
Il flusso stretto della fiamma è associato alle caratteristiche del collo del vaso, e il colore blu intenso gli è conferito dagli ioni rame presenti nella soluzione.
Facciamo lo stesso esperimento, ma in un contenitore diverso:
Quando tutto l'alluminio ha reagito, la soluzione diventa grigia con macchie di rame ridotto sulla superficie. Dovrebbe essere diluito con abbondante acqua e versato nello scarico.
Sul fondo è rimasto del sedimento:
Dovresti anche sbarazzartene, poiché dopo aver provato a filtrare, sul filtro è rimasto un precipitato marrone chiaro e non può essere chiamato rame.
Conclusione
E questo conclude questo articolo. Questa esperienza può essere dimostrata nelle lezioni di chimica a scuola. Buona fortuna a tutti con la vostra ripetizione!
Masterclass simili
Particolarmente interessante
Commenti (2)