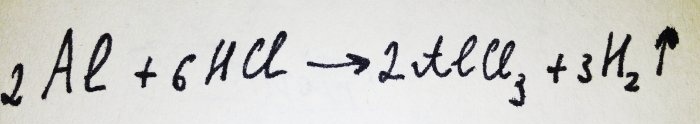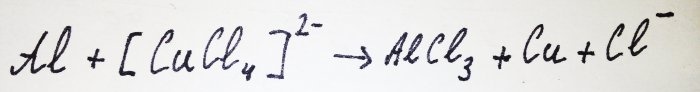Prosty eksperyment - Niebieski płomień
Dzień dobry, dociekliwi chemicy! Dzisiaj przeprowadzimy prosty, ale spektakularny eksperyment.
Jego istotą jest to, że uwolniony podczas reakcji wodór spala się niebieskim płomieniem.
Będziemy więc potrzebować:
Eksperyment przeprowadzimy w szklanym słoju.
Jako naczynia możesz użyć szalki Petriego lub zlewki. Nie polecam używania kolby, ponieważ przepływ tlenu w środku będzie utrudniony ze względu na wąską szyjkę kolby.
Przed przeprowadzeniem tego eksperymentu zdecydowanie zalecam zapoznanie się ze środkami ostrożności podczas pracy z kwasami.
Do słoika wlać łyżeczkę witriolu i dodać 40 ml kwasu. Roztwór zmienia kolor na zielony w wyniku tworzenia się kompleksowego tetrachlorocupranu jonów miedzi [CuCl4]2-.
Teraz pozostało tylko dodać folię aluminiową. Pokryty jest warstwą tlenku, ale powstały kompleks szybko ją niszczy. Następnie część glinu reaguje z kwasem, równanie tej reakcji wygląda następująco:
Jak widać z reakcji, wydziela się wodór.
Reszta aluminium oddziałuje z kompleksem, wypierając z niego miedź:
Reakcje zachodzą szybko, uwalniając duże ilości ciepła.
Uwolniony wodór dobrze pali się w powietrzu, podpalmy go.
Wąski przepływ płomienia jest związany z charakterystyką szyjki słoika, a bogaty niebieski kolor nadają mu jony miedzi obecne w roztworze.
Zróbmy ten sam eksperyment, ale w innym pojemniku:
Kiedy całe aluminium przereaguje, roztwór staje się szary z plamami zredukowanej miedzi na powierzchni. Należy go rozcieńczyć dużą ilością wody i wylać do kanalizacji.
Na dnie pozostał osad:
Powinieneś się go również pozbyć, ponieważ po próbie filtrowania na filtrze pozostał jasnobrązowy osad i nie można go nazwać miedzią.
I na tym kończy się ten artykuł. Doświadczenie to można wykazać na lekcjach chemii w szkole. Powodzenia wszystkim w powtarzaniu!
Jego istotą jest to, że uwolniony podczas reakcji wodór spala się niebieskim płomieniem.
Odczynniki
Będziemy więc potrzebować:
- Stężenie kwasu solnego 15%;
- siarczan miedzi;
- Folia aluminiowa.
Eksperyment przeprowadzimy w szklanym słoju.
Jako naczynia możesz użyć szalki Petriego lub zlewki. Nie polecam używania kolby, ponieważ przepływ tlenu w środku będzie utrudniony ze względu na wąską szyjkę kolby.
Eksperyment
Przed przeprowadzeniem tego eksperymentu zdecydowanie zalecam zapoznanie się ze środkami ostrożności podczas pracy z kwasami.
Do słoika wlać łyżeczkę witriolu i dodać 40 ml kwasu. Roztwór zmienia kolor na zielony w wyniku tworzenia się kompleksowego tetrachlorocupranu jonów miedzi [CuCl4]2-.
Teraz pozostało tylko dodać folię aluminiową. Pokryty jest warstwą tlenku, ale powstały kompleks szybko ją niszczy. Następnie część glinu reaguje z kwasem, równanie tej reakcji wygląda następująco:
Jak widać z reakcji, wydziela się wodór.
Reszta aluminium oddziałuje z kompleksem, wypierając z niego miedź:
Reakcje zachodzą szybko, uwalniając duże ilości ciepła.
Uwolniony wodór dobrze pali się w powietrzu, podpalmy go.
Wąski przepływ płomienia jest związany z charakterystyką szyjki słoika, a bogaty niebieski kolor nadają mu jony miedzi obecne w roztworze.
Zróbmy ten sam eksperyment, ale w innym pojemniku:
Kiedy całe aluminium przereaguje, roztwór staje się szary z plamami zredukowanej miedzi na powierzchni. Należy go rozcieńczyć dużą ilością wody i wylać do kanalizacji.
Na dnie pozostał osad:
Powinieneś się go również pozbyć, ponieważ po próbie filtrowania na filtrze pozostał jasnobrązowy osad i nie można go nazwać miedzią.
Wniosek
I na tym kończy się ten artykuł. Doświadczenie to można wykazać na lekcjach chemii w szkole. Powodzenia wszystkim w powtarzaniu!
Podobne klasy mistrzowskie
Szczególnie interesujące
Komentarze (2)