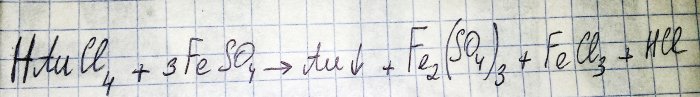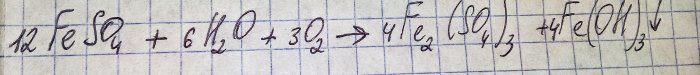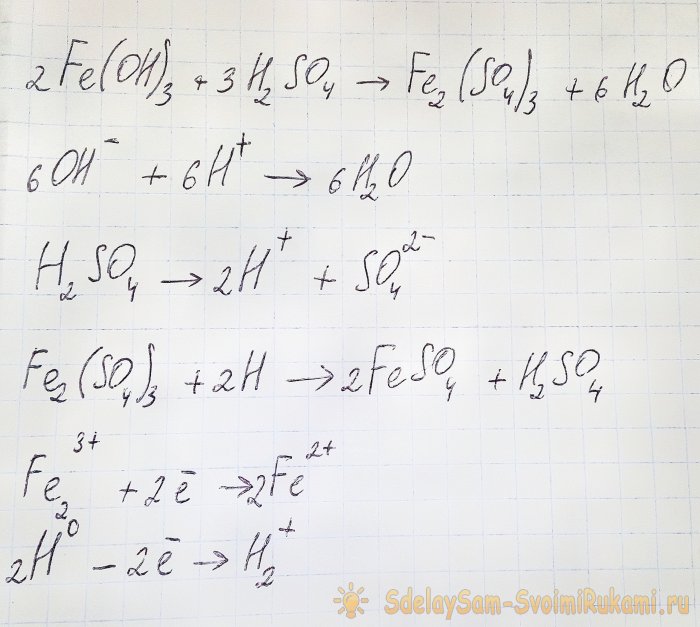Szybki sposób na uzyskanie siarczanu żelazawego z nawozu
Przedostatnim krokiem na drodze do otrzymania metalu szlachetnego z komponentów radiowych jest redukcja tego ostatniego z odpowiedniego chlorku. Siarczan żelaza(II) doskonale nadaje się do tych celów. Rozważmy równanie tej reakcji:
HAuCl4 – tetrachloroaurynian (III) wodoru – związek powstający podczas rozpuszczania złota w wodzie królewskiej. Nie będziemy na razie zagłębiać się w ten proces, gdyż zasługuje on na osobny artykuł.
Zatem siarczan (zwany dalej siarczanem żelaza(II)) jest jednym z tanich i łatwo dostępnych środków redukujących. W sklepach można go znaleźć pod nazwą „siarczan żelaza”, jest to nawóz. Ale to nie jest czysta substancja, zawartość siarczanów wynosi około 50%, reszta to zanieczyszczenia. Zanim będziemy mogli przywrócić złoto, musimy oczyścić nasz siarczan.
Będzie potrzebował
Do tego będziesz potrzebować:
- Siarczan żelaza (sprzedawany w sklepach typu „wszystko do ogrodu”; kupiłem kilogram, żeby starczyło mi na głowę);
- Roztwór kwasu siarkowego, znany również jako kwaśny elektrolit do akumulatorów (w salonach samochodowych);
- Alkohol, użyłem 95%;
- Zastawa stołowa chemiczna lub jednorazowa (kubki, łyżki do mieszania).
Siarczan żelaza pozyskujemy z nawozu
Do przygotowania roztworu używam szklanego słoika. Wewnątrz znajduje się 500 ml gorącej wody, może trochę mniej.
Teraz odmierz około pół szklanki nawozu:
Jak widać substancja ma kolor żółtobrązowy, taki brudny „siarczan” można stosować wyłącznie zgodnie z jego przeznaczeniem - do opryskiwania roślinności. Mamy inne cele.
Wlać do słoika:
Roztwór zmienił nieprzyjemny brązowy kolor. Zabarwienie powstało w wyniku reakcji nawozu z wodą:
Żelazo w siarczanie utlenia się do postaci trójwartościowej i wytrąca się wodorotlenek żelaza(III), co właściwie jest przyczyną jego koloru.
Aby z otrzymanych związków otrzymać interesujący nas siarczan należy zakwasić roztwór kwasem siarkowym. Dodawaj małymi porcjami, aż roztwór się rozjaśni.
W takim przypadku zachodzą następujące reakcje:
Wodorotlenek reaguje z kwasem, tworząc siarczan żelaza (III) (reakcja wymiany jonowej). Ten z kolei reaguje z wodorem atomowym, który powstaje podczas dysocjacji kwasu siarkowego. Ostatnią reakcją jest redoks.
Teraz roztwór zawiera dokładnie tyle siarczanu, ile potrzebujemy, ale sam roztwór jest nadal mętny. Pozostawić i przefiltrować, ja użyłem filtra chemicznego.
Na dnie słoika pozostały nierozpuszczalne zanieczyszczenia:
Opłukujemy go i wlewamy do niego przefiltrowany roztwór. Jest znacznie lżejszy i czystszy niż oryginał.
Alkohol etylowy wypiera sole kwasów dwuzasadowych z ich roztworów. Wykorzystamy tę właściwość do otrzymania stałego siarczanu. Do roztworu dodajemy alkohol, wlałem 200 ml, co odpowiada objętości nieco ponad połowie pierwotnej objętości nawozu.
Na dnie pojawiły się kryształy naszego siarczanu.
Roztwór pozostawiłem na dwa dni, aby cały siarczan miał czas na wytrącenie się.
Aby przyspieszyć ten proces, możesz początkowo dodać więcej alkoholu.
Odcedź płyn, opukawszy od dna i delikatnie podgrzewając, oddziel siarczan od słoika i wylej go na papierowy ręcznik do wyschnięcia.
Po kilku godzinach siarczan przelać do szklanego słoika, oznaczyć substancję i w tej formie można ją długo przechowywać.
Ponieważ wytrąciły się krystaliczne hydraty, skład substancji jest taki jak na zdjęciu. Ale to nie przeszkadza nam w wykorzystaniu go do własnych celów, i tak rozpuszczając go w wodzie.
Wniosek
Środki ostrożności i przestrzeganie zasad postępowania z kwasami są oczywistością. W żadnym wypadku nie powinniśmy o nich zapominać.
Czyste substancje dla każdego!
Podobne klasy mistrzowskie
Szczególnie interesujące
Komentarze (1)