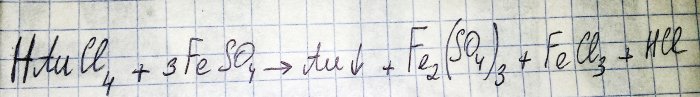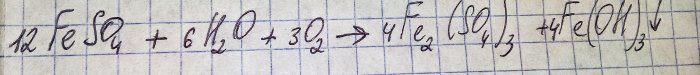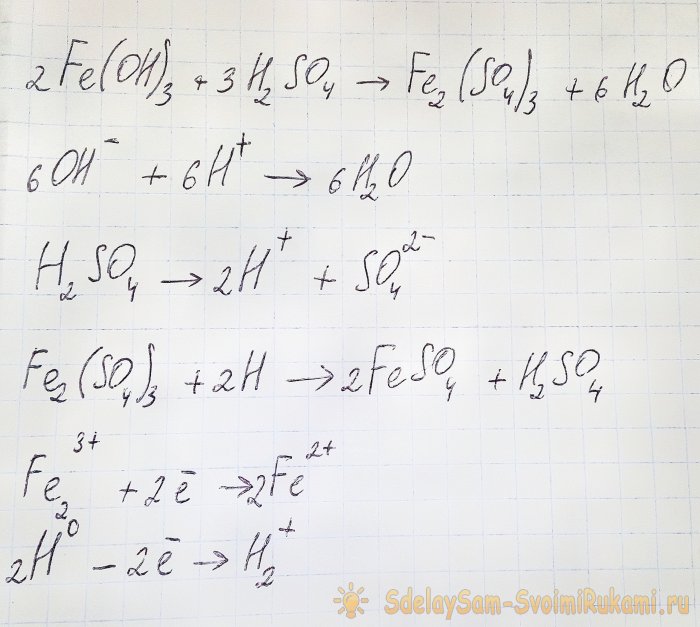Eine schnelle Möglichkeit, Eisensulfat aus Dünger zu gewinnen
Der vorletzte Schritt auf dem Weg zur Gewinnung eines Edelmetalls aus Radiokomponenten ist deren Reduktion aus dem entsprechenden Chlorid. Eisen(II)sulfat eignet sich hervorragend für diese Zwecke. Betrachten Sie die Gleichung für diese Reaktion:
HAuCl4 – Hydrogentetrachloraurat (III) – eine Verbindung, die entsteht, wenn Gold in Königswasser gelöst wird. Auf diesen Prozess gehen wir vorerst nicht näher ein, da er einen gesonderten Artikel verdient.
So gehört Sulfat (im Folgenden Eisen(II)sulfat gemeint) zu den preiswerten und leicht verfügbaren Reduktionsmitteln. Im Handel ist es unter dem Namen „Eisensulfat“ zu finden, es handelt sich um einen Dünger. Dies ist jedoch kein reiner Stoff, der Sulfatanteil beträgt etwa 50 %, der Rest sind Verunreinigungen. Und bevor wir das Gold wiederherstellen können, müssen wir unser Sulfat reinigen.
Wird benötigt
Dazu benötigen Sie:
- Eisensulfat (wird in Geschäften wie „Alles für den Garten“ verkauft; ich habe ein Kilogramm gekauft, damit ich genug für meinen Kopf hatte);
- Schwefelsäurelösung, auch Säureelektrolyt für Batterien genannt (im Autohaus);
- Alkohol habe ich zu 95 % verwendet;
- Chemie- oder Einweggeschirr (Becher, Rührlöffel).
Eisensulfat gewinnen wir aus Düngemitteln
Zur Zubereitung der Lösung verwende ich ein Glasgefäß. Im Inneren befinden sich 500 ml heißes Wasser, vielleicht auch etwas weniger.
Jetzt etwa ein halbes Glas Dünger abmessen:
Wie Sie sehen, hat die Substanz eine gelbbraune Farbe; solch schmutziges „Sulfat“ kann nur für den vorgesehenen Zweck verwendet werden – zum Besprühen der Vegetation. Wir haben andere Ziele.
Gießen Sie es in das Glas:
Die Lösung nahm eine unangenehme braune Farbe an. Die Verfärbung erfolgte durch die Reaktion des Düngers mit Wasser:
Eisen im Sulfat wird zum dreiwertigen Eisen oxidiert und Eisen(III)-hydroxid fällt aus, was eigentlich der Grund für seine Farbe ist.
Um aus den resultierenden Verbindungen das gewünschte Sulfat zu gewinnen, ist es notwendig, die Lösung mit Schwefelsäure anzusäuern. In kleinen Portionen hinzufügen, bis die Lösung heller wird.
In diesem Fall kommt es zu folgenden Reaktionen:
Das Hydroxid reagiert mit der Säure zu Eisen(III)sulfat (Ionenaustauschreaktion). Es wiederum reagiert mit atomarem Wasserstoff, der bei der Dissoziation von Schwefelsäure entsteht. Die letzte Reaktion ist Redox.
Jetzt enthält die Lösung genau das Sulfat, das wir brauchen, aber die Lösung selbst ist immer noch trüb. Lassen Sie es stehen und filtern Sie es. Ich habe einen chemischen Filter verwendet.
Am Boden des Glases verblieben unlösliche Verunreinigungen:
Wir spülen es aus und gießen die gefilterte Lösung hinein. Es ist viel leichter und sauberer als das Original.
Ethylalkohol verdrängt Salze zweibasiger Säuren aus ihren Lösungen. Diese Eigenschaft werden wir nutzen, um festes Sulfat zu gewinnen. Wir fügen der Lösung Alkohol hinzu, ich habe 200 ml eingegossen, was etwas mehr als der Hälfte des ursprünglichen Düngervolumens entspricht.
Am Boden erschienen Kristalle unseres Sulfats.
Ich ließ die Lösung zwei Tage stehen, damit das gesamte Sulfat ausfallen konnte.
Sie können zunächst mehr Alkohol hinzufügen, um diesen Vorgang zu beschleunigen.
Lassen Sie die Flüssigkeit ab, indem Sie auf den Boden klopfen und leicht erhitzen, trennen Sie das Sulfat aus dem Glas und gießen Sie es zum Trocknen auf ein Papiertuch.
Gießen Sie das Sulfat nach einigen Stunden in ein Glasgefäß, beschriften Sie die Substanz und in dieser Form ist sie lange haltbar.
Da kristalline Hydrate ausfielen, ist die Formel der Substanz wie im Bild. Dies hindert uns jedoch nicht daran, es für unsere eigenen Zwecke zu verwenden und es trotzdem in Wasser aufzulösen.
Abschluss
Sicherheitsvorkehrungen und die Einhaltung der Regeln im Umgang mit Säuren sind selbstverständlich. Unter keinen Umständen sollten wir sie vergessen.
Saubere Substanzen an alle!
Ähnliche Meisterkurse
Besonders interessant
Kommentare (1)